题目内容
【题目】水是重要的物质,在实验室中常用于溶解物质,配制溶液.
(1)水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是
A.面粉
B.白糖
C.冰块
D.植物油
E.硝酸钾
(2)汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.请回答下列有关问题:
①若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为mL;
②该实验的主要步骤有:计算、、稀释配制、装瓶并贴标签.
③用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数20%(填“大于”、“小于”或“等于”).
(3)向50mL水(密度为1g/mL)中溶解一定量KNO3固体的操作如下,请根据如图甲实验现象和溶解度曲线回答. 
①A、B、C中一定是饱和溶液的是 , 一定是不饱溶液的是;(填字母)
②当x=g时,B中恰好没有固体剩余;
③硝酸钾从溶液中析出晶体常用方法.
(4)如图乙为A、B、C三种物质的溶解度曲线,完成下列问题:
①P点表示的含义是 .
②将t2℃时A、B、C三种物质的饱和溶液各100g降温到t1℃时,所得溶液中溶质的质量分数的大小关系是 .
【答案】
(1)ACD
(2)390;量取;小于
(3)B;A;5.8;降温结晶(或冷却热饱和溶液)
(4)t2℃时A、B的溶解度相等;B>A>C
【解析】解:(1)面粉和植物油均不能溶于水,冰块溶于水形成的是纯净物,其余物质均能溶于水中形成均一、稳定的混合物﹣﹣溶液;(2)①浓硫酸中溶质质量:100g×98%=98g,要配制的溶液的质量为 ![]() =490g,需要水的质量为:490g﹣100g=390.0g(合390mL的水);②该实验的主要步骤有:计算、量筒量取液体、然后在烧杯中稀释配制、装瓶并贴标签;③用量筒量取浓硫酸时俯视读数,会使量取的浓硫酸的量偏小,所以溶液中溶质质量偏小,则所配溶液溶质质量分数偏小;(3)①20℃时硝酸钾的溶解度是31.6g,50mL水就是50g水,能溶解硝酸钾的质量最多是15.8g,故加入10g硝酸钾形成的A溶液是不饱和溶液,继续加入Xg硝酸钾,形成的溶液B有固体剩余,故B是饱和溶液,温度升高到T℃形成的溶液C,固体无剩余,因为不知道具体的温度,故硝酸钾可以是恰好溶解形成饱和溶液,也可能是溶解后形成不饱和溶液;②要使X恰好完全溶解,则X,15.8g﹣10g=5.8g;③硝酸钾的溶解度随温度升高而增大,且变化较大,所以要得到其晶体可采取降温结晶或冷却热饱和溶液的方法;(4)①P点是t2℃时A、B的溶解度曲线的交点,表示二者的溶解度相等;②将t2℃时A、B、C三种物质的饱和溶液各100g降温到t1℃时,AB溶解度减小析出晶体,溶质的质量分数减小,C无晶体析出,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数=
=490g,需要水的质量为:490g﹣100g=390.0g(合390mL的水);②该实验的主要步骤有:计算、量筒量取液体、然后在烧杯中稀释配制、装瓶并贴标签;③用量筒量取浓硫酸时俯视读数,会使量取的浓硫酸的量偏小,所以溶液中溶质质量偏小,则所配溶液溶质质量分数偏小;(3)①20℃时硝酸钾的溶解度是31.6g,50mL水就是50g水,能溶解硝酸钾的质量最多是15.8g,故加入10g硝酸钾形成的A溶液是不饱和溶液,继续加入Xg硝酸钾,形成的溶液B有固体剩余,故B是饱和溶液,温度升高到T℃形成的溶液C,固体无剩余,因为不知道具体的温度,故硝酸钾可以是恰好溶解形成饱和溶液,也可能是溶解后形成不饱和溶液;②要使X恰好完全溶解,则X,15.8g﹣10g=5.8g;③硝酸钾的溶解度随温度升高而增大,且变化较大,所以要得到其晶体可采取降温结晶或冷却热饱和溶液的方法;(4)①P点是t2℃时A、B的溶解度曲线的交点,表示二者的溶解度相等;②将t2℃时A、B、C三种物质的饱和溶液各100g降温到t1℃时,AB溶解度减小析出晶体,溶质的质量分数减小,C无晶体析出,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数= ![]() ×100%,即溶解度大则溶质的质量分数大,而降温后B的溶解度大于A的溶解度大于降温前C的溶解度,故所得溶液中溶质的质量分数的大小关系是B>A>C;所以答案是:(1)ACD;(2)①390;②;量取;③小于;(3)①B;A;②5.8;③降温结晶(或冷却热饱和溶液);(4)①t2℃时A、B的溶解度相等;②B>A>C.
×100%,即溶解度大则溶质的质量分数大,而降温后B的溶解度大于A的溶解度大于降温前C的溶解度,故所得溶液中溶质的质量分数的大小关系是B>A>C;所以答案是:(1)ACD;(2)①390;②;量取;③小于;(3)①B;A;②5.8;③降温结晶(或冷却热饱和溶液);(4)①t2℃时A、B的溶解度相等;②B>A>C.
【考点精析】本题主要考查了结晶的原理、方法及其应用和饱和溶液和不饱和溶液的相关知识点,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解才能正确解答此题.

【题目】下列4个坐标图分别表示4个实验过程中某些物质质量的变化,其中正确的是( )
A | B | C | D |
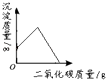
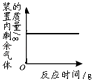
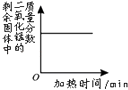
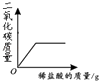
向一定量的石灰水中通入二氧化碳 | 在某一密闭容器内点燃红磷 | 加热一定量氯酸钾和二氧化锰的固体混合物 | 向一定量石灰石中滴加稀盐酸 |
|
|
|
|
A.A
B.B
C.C
D.D