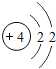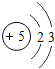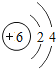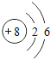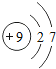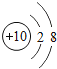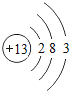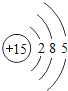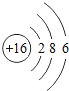题目内容
【题目】密闭容器中有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,则下列说法不正确的是( )
物质 | X | Y | Z | Q |
反应前质量/g | 8 | 2 | 40 | 5 |
反应后质量/g | 待测 | 24 | 8 | 23 |
A.其中X、Z为反应物
B.其中Y和Q为生成物
C.反应后X的质量为0
D.反应后生成Y、Q的质量比为![]() .
.
【答案】D
【解析】
Y反应后质量增加了,属于生成物,且生成了:24g-2g=22g;Z的质量减少了,属于反应物,且参加反应的质量是:40g-8g=32g;Q的质量增加了,属于生成物,且生成了:23g-5g=18g;由于生成物质量总和是:22g+18g=40g,而反应物质量为32g,所以X是反应物,且参加反应的质量为:40g-32g=8g;所以X反应后的质量是0。
A、由分析可知,反应物是X和Z,生成物是Y和Q,故说法正确;
B、由分析可知,反应物是X和Z,生成物是Y和Q,故说法正确;
C、由分析可知,X反应后的质量是0,故说法正确;
D、由分析可知,反应后生成Y、Q的质量比为22:18,故说法错误。
故选D。

 期末宝典单元检测分类复习卷系列答案
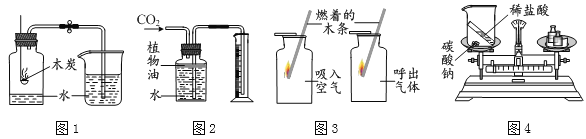
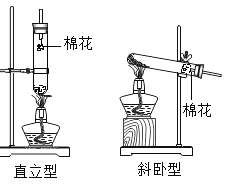
期末宝典单元检测分类复习卷系列答案【题目】某兴趣小组同学阅读产品标签发现,市售化学纯或分析纯高锰酸钾的纯度高达![]() ,含水量可以忽略不计。小组同学设计了直立型装置制取氧气,并与传统斜卧型装置相比较,如图,各放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值。
,含水量可以忽略不计。小组同学设计了直立型装置制取氧气,并与传统斜卧型装置相比较,如图,各放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值。
装置类型 | 收集1瓶氧气所需时间 | 收集2瓶氧气所需时间 | 生成氧气的总体积 |
直立型 |
|
| 552mL |
斜卧型 |
|
| 456mL |
(1)小组同学用直立型装置制取氧气时,不需在试管口放一团棉花的原因是______。
(2)等质量的高锰酸钾充分反应,斜卧型装置收集到的氧气较少的主要原因是______。
(3)收集等体积氧气,所需时间较短的装置是______;原因是______。
A 试管底部被火焰充分包围,升温快
B 药品受热面积大,温度高
C 加热过程中无需移动火焰,药品处于持续高温中。
(4)根据高锰酸钾的质量算出的氧气体积为理论值。实验中发现,两种装置制取的氧气质量均明显大于理论值,同学们对其原因进行了探究。
(提出猜想)
猜想1:可能是反应生成的二氧化锰在较高温度下受热分解放出氧气
猜想2:可能是反应生成的锰酸钾在较高温度下受热分解放出氧气
猜想3:______。作出以上猜想的理由是______。
(实验验证)实验a:取一定量的二氧化锰于试管中,加热一段时间,冷却后测得二氧化锰的质量不变,证明猜想______错误。
实验b:取少量锰酸钾于试管中,加热一段时间,冷却,若______则猜想2正确。
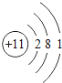
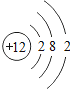
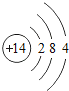
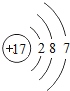
【题目】核电荷数为1﹣18的原子结构示意图等信息如下,请回答下列问题:
第一周期 | 1H
| 2He
| ||||||
第二周期 | 3Li
| 4Be
| 5B
| 6C
| 7N
| 8O
| 9F
| 10Ne
|
第三周期 | 11Na
| 12Mg
| 13Al
| 14Si
| 15P
| 16S
| 17Cl
| 18Ar
|
(1)不同种元素最本质的区别是_____(选填序号)
A质子数不同 B最外层电子数不同 C中子数不同 D相对原子质量不同
(2)在第三周期中,各原子结构的共同之处是_____;该周期中,各原子核外电子排布的变化规律是________.
(3)氧元素应位于元素周期表中第_______族.氧元素与地壳中含量最多的金属元素组成的物质的化学符号为_______。