��Ŀ����
����Ŀ��ͨ�����ڵĻ�ѧѧϰ��Ӧ��֪���ж���;��������ȡ�������磺
A�����ˮ B���������
C�����ȸ������ D���ֽ��������
E����������
��1����������E��������д����һ����ȡ�����ķ���;
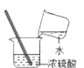
��2��ʵ����һ�㲻�÷���A��ȡ������ԭ������
��3��������ͼװ�ü��ȸ��������ȡ������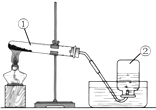
д��������������ƣ���������ʵ�����ø�����������������ֱ���ʽΪ��ʵ�������ֹͣ����ʱҪ�Ȱѵ����Ƴ�ˮ�棬�������� �� ��ʱ����ˮ���е�ˮ�����dz�Ϻ�ɫ������Ϊ�����������ԭ���������
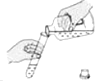
��4�����ֽ����������ȡ��������ѡ�õ�װ�����£�
Ҫ�õ�ƽ�ȵ���������Ӧѡ�õķ���װ������ѡ��ס����ҡ��������ñ�װ���ռ����ɵ�����������Ӧ����ѡ�a����b�����˵��롣
���𰸡�
��1�������������������̵Ļ����
��2�����Ĵ����ĵ���
��3���Թ�,����ƿ,������� ![]() �����+��������+����,Ϊ��ֹˮ�������Թ�,�����Թܵ�ը��,�Թܿ�û��һ����
�����+��������+����,Ϊ��ֹˮ�������Թ�,�����Թܵ�ը��,�Թܿ�û��һ����
��4����,a
����������1��ʵ���һ�����ʹ�ü����������������̵Ļ����ķ�����ȡ������ ��2�����ˮ��Ҫ���Ĵ����ĵ��ܣ�����ʵ�����в��ô˷�����ȡ��������3�������Թܣ����Ǽ���ƿ����������ڼ��ȵ���������������ء��������̺������������ֱ���ʽΪ������� ![]() �����+��������+������ʵ�������Ϊ��ֹˮ�������Թܣ������Թܵ�ը�ѣ������Ƚ������Ƴ�ˮ�棬��Ϩ��ƾ��ƣ�Ϊ��ֹ������ؿ����ص��ܽ���ˮ�ۣ�ˮ������Ϻ�ɫ��Ӧ���Թܿ�Ӧ��һ��������4���ֽ����������ȡ������Ҫ�õ�ƽ�ȵ���������ѡ�õķ���װ���Ǽף�ע�����ɿ��ƹ�������ĵμӵĿ��������ڿ��Ʒ�Ӧ���ʣ��õ�ƽ�ȵ����������������ܶȱȿ��������Դӳ��ܽ��롣
�����+��������+������ʵ�������Ϊ��ֹˮ�������Թܣ������Թܵ�ը�ѣ������Ƚ������Ƴ�ˮ�棬��Ϩ��ƾ��ƣ�Ϊ��ֹ������ؿ����ص��ܽ���ˮ�ۣ�ˮ������Ϻ�ɫ��Ӧ���Թܿ�Ӧ��һ��������4���ֽ����������ȡ������Ҫ�õ�ƽ�ȵ���������ѡ�õķ���װ���Ǽף�ע�����ɿ��ƹ�������ĵμӵĿ��������ڿ��Ʒ�Ӧ���ʣ��õ�ƽ�ȵ����������������ܶȱȿ��������Դӳ��ܽ��롣
�����㾫�������������Ĺ�ҵ�Ʒ�����������ȡװ���ǽ����ĸ�������Ҫ֪����ҵ��������������Һ̬��������ԭ��:�����������ķе㲻ͬ��������װ�ã��̹̼����͡���Һ�������ͣ�

����Ŀ����Ҫ��ش����⣺
��1������˫��ˮ�Ͷ����������������ķ��ű���ʽΪ����ijͬѧ���˸�ʵ���չ��������˼����̽����
��2������MnO2�������Է�Ӧ������û��Ӱ���أ�
����������һ��ʵ�飺ÿ�ξ���30mL10%��H2��2��Һ�����ò�ͬ��MnO2��ĩ���������ⶨ�����ռ���500mL����ʱ���õ�ʱ�䣬������£�������ʵ����������ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2��ĩ�������ˣ� | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
����ʱ�䣨�룩 | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
������������ݻش�MnO2�������Է�Ӧ������û��Ӱ���أ�����У�������Ӱ����أ�
����
��3��H2O2��Һ���������������Է�Ӧ������û��Ӱ���أ�
��������һ��ʵ�飺ÿ�ξ�ȡ5mL30%��H2O2��Һ��Ȼ��ϡ�ͳɲ�ͬ����������������Һ����ʵ�顣��¼�������£���ʵ�����20�������½��У�����ʵ������Ҳ����ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H2O2��Һ������������ | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2��ĩ�������ˣ� | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
�ռ���540mL����ʱ����ʱ�䣨�룩 | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
��Ӧ��Һ���¶ȣ��棩 | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
������������ݻش�H2O2��Һ���������������Է�Ӧ������û��Ӱ���أ�����У�������Ӱ����أ�
�����ɱ������ݻ��ɿ������÷�Ӧ�ᣨѡ����ȡ������ȡ�����
��4��������Щ���ؿ���Ӱ��÷�Ӧ�������أ�
��˵�����һ�����룺��