题目内容
【题目】请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: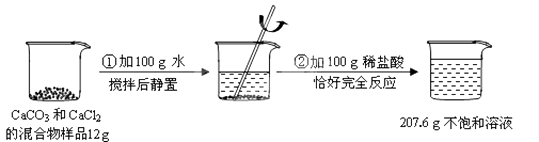
(1)实验过程中产生的CO 2气体的质量为g。
(2)计算CaCO3中各元素的质量比。
(3)计算反应后的CaCl 2 不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
【答案】
(1)4.4
(2)10:3:12
(3)解: 设原混合物中 CaCO3的质量为x,生成氯化钙的质量为y。
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 111 | 44 | |
x | y | 4.4g |
![]()
x=10g
y=11.1g
溶液中氯化钙的质量=11.1g+(12g-10g)=13.1g
溶液中氯化钙的质量分数= ![]() =6.3%
=6.3%
答:不饱和溶液中溶质的质量分数为6.3%。
【解析】解:(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g;(2)CaCO3中各元素的质量比=40:12:(16×3)=10:3:12;根据反应前后物质的质量变化,可以得出生成二氧化碳的质量,利用二氧化碳的质量结合方程式可以计算出碳酸钙和氯化钙的质量,利用质量分数的计算解答,要注意的是氯化钙有两部分组成

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
