题目内容
 置换反应是化学反应的基本类型之一.
置换反应是化学反应的基本类型之一.
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来.如铜和硝酸银溶液的化学方程式为________.
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:
Cl2+2NaBr=2NaCl+Br2,I2+Na2s=2NaI+S↓,Br2+2KI=2KBr+I2
由此可判断:①S、Cl2、I2、Br2非金属活动性由强到弱顺序是________.
②下列化学方程式书写错误的是________.
A.Cl2+2NaI=2NaCl+I2 B.I2+2Kbr=2KI+Br2
C.Br2+Na2S=2NaBr+S↓ D.Cl2+K2s=2KCl+s↓
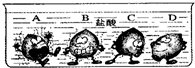
(3)京京同学对金属活动性顺序等知识进行了研究.
根据图中的实验现象判断,稀盐酸里的A、B、C、D四种金属中,金属活动性由强到弱顺序是(填字母)________.
解:(1)铜和硝酸银溶液反应生成了银和硝酸铜,反应的方程式是:Cu+2AgNO3═Cu(NO3)2+2Ag;
(2)由反应可知:Cl2能把Br2从NaBr溶液中置换出来,说明了Cl2活动性大于Br2;I2能把S从Na2S溶液中置换出来,说明了I2活动性大于S;Br2能把I2
从KI溶液中置换出来,说明了Br2活动性大于I2;由此可知:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 Cl2>Br2>I2>S;
(3)A.Cl2+2NaI=2NaCl+I2 方程式书写正确;
B、I2+2Kbr=2KI+2+Br2中“br”应写成Br,由于Br2活动性大于I2,反应不能发生;
C、Br2+Na2S=2NaBr+S↓,方程式书写正确;
D、Cl2+K2s=2KCl+↓中的“s”要大写,方程式书写错误.
(4)从图中不难看出,A、B、C金属的表面有气泡冒出,只有金属D的表面没有气泡冒出,即在金属活动性顺序中A、B、C位于去氢前面,D位于氢的后面.再根据反应的剧烈程度可知,金属的活泼性的大小是:A>B>C>D.
故答为:(1)Cu+2AgNO3═Cu(NO3)2+2Ag;(2)Cl2>Br2>I2>S;(3)BD;(4)A>B>C>D.
分析:(1)根据铜和硝酸银溶液反应生成了银和硝酸铜,写出反应的方程式;
(2)根据活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,来比较非金属单质活动性的强弱;
(3)根据书写化学方程式要遵循的两个原则检查化学方程式;
(4)观察图示,根据是金属与酸是否发生反应以及反应的剧烈程度分析比较金属活动性由强到弱的顺序.
点评:本题主要考查了对金属活动性顺序的应用.根据金属活动性顺序来判断反应的发生,或根据反应的发生剧烈程度判断金属的活动性强弱,从而加强学生对金属活动性顺序的理解.
(2)由反应可知:Cl2能把Br2从NaBr溶液中置换出来,说明了Cl2活动性大于Br2;I2能把S从Na2S溶液中置换出来,说明了I2活动性大于S;Br2能把I2
从KI溶液中置换出来,说明了Br2活动性大于I2;由此可知:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 Cl2>Br2>I2>S;
(3)A.Cl2+2NaI=2NaCl+I2 方程式书写正确;
B、I2+2Kbr=2KI+2+Br2中“br”应写成Br,由于Br2活动性大于I2,反应不能发生;
C、Br2+Na2S=2NaBr+S↓,方程式书写正确;
D、Cl2+K2s=2KCl+↓中的“s”要大写,方程式书写错误.
(4)从图中不难看出,A、B、C金属的表面有气泡冒出,只有金属D的表面没有气泡冒出,即在金属活动性顺序中A、B、C位于去氢前面,D位于氢的后面.再根据反应的剧烈程度可知,金属的活泼性的大小是:A>B>C>D.
故答为:(1)Cu+2AgNO3═Cu(NO3)2+2Ag;(2)Cl2>Br2>I2>S;(3)BD;(4)A>B>C>D.
分析:(1)根据铜和硝酸银溶液反应生成了银和硝酸铜,写出反应的方程式;
(2)根据活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,来比较非金属单质活动性的强弱;
(3)根据书写化学方程式要遵循的两个原则检查化学方程式;
(4)观察图示,根据是金属与酸是否发生反应以及反应的剧烈程度分析比较金属活动性由强到弱的顺序.
点评:本题主要考查了对金属活动性顺序的应用.根据金属活动性顺序来判断反应的发生,或根据反应的发生剧烈程度判断金属的活动性强弱,从而加强学生对金属活动性顺序的理解.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

 置换反应是化学反应的基本类型之一.
置换反应是化学反应的基本类型之一.