题目内容
(2007?大连)图(Ⅰ)是实验室里测定空气中氧气含量的装置.
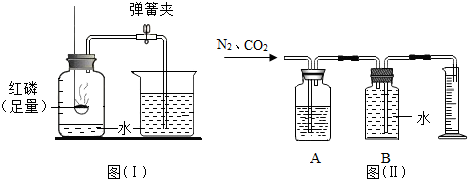
(1)红磷在空气中燃烧的化学方程式为
(2)当红磷熄灭并冷却到室温后,打开弹簧夹,看到的现象是
(3)如果红磷熄灭后没有完全冷却到室温就打开弹簧夹,实验测定结果会偏低,其原因是
(4)上述实验提供了一种粗略测定混合气体中某种气体体积含量的方法.如果要测定氮气、二氧化碳混合气体中二氧化碳的体积量,可将一定体积的混合气体样品通入图(Ⅱ)所示的装置.其中A瓶中装有足量的

(1)红磷在空气中燃烧的化学方程式为
4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
.
| ||
(2)当红磷熄灭并冷却到室温后,打开弹簧夹,看到的现象是
烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一
烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一
.(3)如果红磷熄灭后没有完全冷却到室温就打开弹簧夹,实验测定结果会偏低,其原因是
与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少
与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少
.(4)上述实验提供了一种粗略测定混合气体中某种气体体积含量的方法.如果要测定氮气、二氧化碳混合气体中二氧化碳的体积量,可将一定体积的混合气体样品通入图(Ⅱ)所示的装置.其中A瓶中装有足量的
氢氧化钠
氢氧化钠
溶液,实验结束后,量筒中水的体积约等于氮气
氮气
的体积.分析:(1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)红磷燃烧生成白色固体五氧化二磷而使瓶内气体减少,压强减小,冷却至室室时,打开弹簧夹,在大气压作用下水进行瓶中,补充消耗气体所占有的体积.
(3)根据与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少进行分析.
(4)根据测定混合气体中氮气的体积分数,说明必须将二氧化碳吸收掉的原理去考虑.
(2)红磷燃烧生成白色固体五氧化二磷而使瓶内气体减少,压强减小,冷却至室室时,打开弹簧夹,在大气压作用下水进行瓶中,补充消耗气体所占有的体积.
(3)根据与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少进行分析.
(4)根据测定混合气体中氮气的体积分数,说明必须将二氧化碳吸收掉的原理去考虑.
解答:解:(1)红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2
2P2O5.
(2)待燃烧停止并冷却至室温时打开弹簧夹,由于瓶内气体减少而使压强小于外界大气压,在大气压的作用下,烧杯内的水会沿导管流入瓶内,补充减少的气体所占据的体积,可观察到烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一.
(3)如果红磷熄灭后没有完全冷却到室温就打开弹簧夹,与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少.
(4)粗略测定混合气体中氮气的体积分数,是通过用一氧化碳排出水,测出水的体积,即为氮气的体积,所以要把其中的二氧化碳除掉,用氢氧化钠溶液就能吸收掉.
故答案为:
(1)4P+5O2
2P2O5;
(2)烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一;
(3)与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少;
(4)氢氧化钠;氮气.
| ||
(2)待燃烧停止并冷却至室温时打开弹簧夹,由于瓶内气体减少而使压强小于外界大气压,在大气压的作用下,烧杯内的水会沿导管流入瓶内,补充减少的气体所占据的体积,可观察到烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一.
(3)如果红磷熄灭后没有完全冷却到室温就打开弹簧夹,与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少.
(4)粗略测定混合气体中氮气的体积分数,是通过用一氧化碳排出水,测出水的体积,即为氮气的体积,所以要把其中的二氧化碳除掉,用氢氧化钠溶液就能吸收掉.
故答案为:
(1)4P+5O2
| ||
(2)烧杯中的水沿导管流进集气瓶中,约占集气瓶剩余空间的五分之一;
(3)与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水会偏少;
(4)氢氧化钠;氮气.
点评:通过本题要学会测气体体积的方法,通过气体排出水的体积,测出水的体积,即为所测气体体积,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
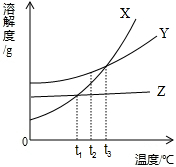 (2007?大连)根据X、Y、Z三种物质的溶解度曲线(如图所示),指出下列错误的说法,并解释原因.
(2007?大连)根据X、Y、Z三种物质的溶解度曲线(如图所示),指出下列错误的说法,并解释原因.