题目内容
(1)正确的实验操作是确保实验成功和安全的前提.试回答:
①量液时,量筒必须放平,视线______.
②用漏斗过滤时,注意漏斗中液体的液面始终要______.
③点燃可燃性的气体如H2前要______.
(2)如图是初中化学学习中的常见装置,请按要求回答下面问题:

①写出标有序号的仪器的名称:Ⅰ______Ⅱ______利用上述装置的组合可以制取氧气,写出有关反应的符号表达式______.
②若用装置E代替装置B收集氧气,氧气应从______(选填“a”或“b”)端导入.
(3)小明同学在空气中点燃镁条时,却发现在生成的白色固体氧化镁中还夹杂着少量的淡黄色固体.
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小明查阅资料,记录了下列几种物质的颜色:
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出猜想]分析资料,小明认为淡黄色固体可能是镁与空气中的______反应生成的.
[实验探究]小明设计实验证实了自己的猜想,他的方案可能是______.
[实验结论]根据小明实验结果,写出镁条在空气中燃烧的两个反应的符号表达式:______;______.
[反思与评价]
①通过此实验的现象,得出镁更易和空气中的______起反应.
②通过上述实验,得出燃烧______(选填“一定”或“不一定”)要有氧气参加.
③小明点燃镁条后生成的固体中镁元素的质量分数______(选填“>”或“=”或“<”)60%.
解:(1)①量液时,量筒必须放平,视线视线与液体的凹液面最低处保持水平,不能仰视或俯视;
②二低:滤纸边缘低于漏斗边缘、滤液低于滤纸边缘;
③可燃性气体不纯点燃有爆炸的危险,所以点燃前一定要验纯.
故答案为:①与量筒内凹液面的最低处保持水平;②低于滤纸的边缘;③验纯.
(2)①图中I是长颈漏斗,II是锥形瓶;过氧化氢可在二氧化锰催化的条件下,在A装置中反应,生成氧气,有关反应的符号表达式为:H2O2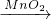 H2O+O2.
H2O+O2.
②因为氧气的密度大于空气的密度,所以装置E代替装置B收集氧气,氧气应从a端导入.
故答案为:①长颈漏斗;锥形瓶;H2O2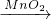 H2O+O2;②a.
H2O+O2;②a.
(3)[查阅资料]根据质量守恒定律,化学反应前后元素的种类不变,由于空气中无氯元素,所以燃烧产物中一定不存在氯化镁;
[提出猜想]空气中含有氮气,在空气中点燃镁条时,生成的白色固体物质中夹杂着少量的淡黄色固体,而氮化镁为淡黄色,所以淡黄色的固体可能是镁与空气中的氮气反应生成的.
[实验探究]由于在纯氧气中燃烧镁条只生成白色固体氧化镁,在纯氮气中燃烧镁条只生成淡黄色色固体氮化镁,可用在纯氮气中燃烧镁条,观察现象的方法.
[实验结论]镁和氧气在点燃的条件下燃烧生成氧化镁,符号表达式为:Mg+O2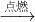 MgO;镁和氮气在点燃的条件下反应生成氮化镁,符号表达式为:Mg+N2
MgO;镁和氮气在点燃的条件下反应生成氮化镁,符号表达式为:Mg+N2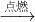 Mg3N2.
Mg3N2.
[反思与评价]①氧气的化学性质活泼,镁更易与空气中的氧气反应;
②一般情况下,氧气有助燃性,可以支持燃烧,而该题中显示镁在氮气中也可以燃烧,所以启示为:物质不一定只在氧气中才能燃烧或氮气通常不支持燃烧,但有时也能支持某些物质的燃烧;
③生成物MgO中Mg占60%,还有Mg3N2中Mg占72%,所以生成的固体中镁元素的质量分数大于60%.
故答案为:[查阅资料]空气的成分中不含氯元素;
[提出猜想]氮气(或N2);
[实验探究]将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体
[实验结论]Mg+O2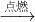 MgO;Mg+N2
MgO;Mg+N2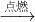 Mg3N2;
Mg3N2;
[反思与评价]①氧气;
②不一定(其他合理答案均可).
③>.
分析:(1)①掌握量筒的使用注意事项;
②过滤液体时,要注意一贴二低三靠的原则;
③可燃性气体不纯点燃有爆炸的危险.
(2)①熟悉常见仪器,了解它们的名称;过氧化氢可在二氧化锰催化的条件下,在A装置中反应,生成氧气;
②装置E代替装置B收集氧气,根据氧气的密度分析进气口.
(3)[查阅资料]根据质量守恒定律确定产物中一定不存在氯化镁;
[提出猜想]根据空气的成分和固体的颜色判断淡黄色固体的来源;
[实验探究]根据在纯氧气中燃烧镁条只生成白色固体,在纯氮气中燃烧镁条只生成淡黄色色固体,可采取在纯纯氮气中燃烧镁条,观察现象的方法;
[实验结论]根据反应的反应物、生成物和反应条件书写方程式;
[反思与评价]根据镁可以在氮气中燃烧这一特殊性质分析回答.
点评:正确理解质量守恒定律的内容,了解燃烧的定义及定义的拓展意义是解决问题的关键,书写化学方程式一定要确定反应物和生成物的化学式.
②二低:滤纸边缘低于漏斗边缘、滤液低于滤纸边缘;
③可燃性气体不纯点燃有爆炸的危险,所以点燃前一定要验纯.
故答案为:①与量筒内凹液面的最低处保持水平;②低于滤纸的边缘;③验纯.
(2)①图中I是长颈漏斗,II是锥形瓶;过氧化氢可在二氧化锰催化的条件下,在A装置中反应,生成氧气,有关反应的符号表达式为:H2O2
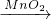 H2O+O2.
H2O+O2.②因为氧气的密度大于空气的密度,所以装置E代替装置B收集氧气,氧气应从a端导入.
故答案为:①长颈漏斗;锥形瓶;H2O2
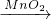 H2O+O2;②a.
H2O+O2;②a.(3)[查阅资料]根据质量守恒定律,化学反应前后元素的种类不变,由于空气中无氯元素,所以燃烧产物中一定不存在氯化镁;
[提出猜想]空气中含有氮气,在空气中点燃镁条时,生成的白色固体物质中夹杂着少量的淡黄色固体,而氮化镁为淡黄色,所以淡黄色的固体可能是镁与空气中的氮气反应生成的.
[实验探究]由于在纯氧气中燃烧镁条只生成白色固体氧化镁,在纯氮气中燃烧镁条只生成淡黄色色固体氮化镁,可用在纯氮气中燃烧镁条,观察现象的方法.
[实验结论]镁和氧气在点燃的条件下燃烧生成氧化镁,符号表达式为:Mg+O2
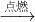 MgO;镁和氮气在点燃的条件下反应生成氮化镁,符号表达式为:Mg+N2
MgO;镁和氮气在点燃的条件下反应生成氮化镁,符号表达式为:Mg+N2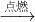 Mg3N2.
Mg3N2.[反思与评价]①氧气的化学性质活泼,镁更易与空气中的氧气反应;
②一般情况下,氧气有助燃性,可以支持燃烧,而该题中显示镁在氮气中也可以燃烧,所以启示为:物质不一定只在氧气中才能燃烧或氮气通常不支持燃烧,但有时也能支持某些物质的燃烧;
③生成物MgO中Mg占60%,还有Mg3N2中Mg占72%,所以生成的固体中镁元素的质量分数大于60%.
故答案为:[查阅资料]空气的成分中不含氯元素;
[提出猜想]氮气(或N2);
[实验探究]将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体
[实验结论]Mg+O2
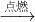 MgO;Mg+N2
MgO;Mg+N2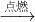 Mg3N2;
Mg3N2;[反思与评价]①氧气;
②不一定(其他合理答案均可).
③>.
分析:(1)①掌握量筒的使用注意事项;
②过滤液体时,要注意一贴二低三靠的原则;
③可燃性气体不纯点燃有爆炸的危险.
(2)①熟悉常见仪器,了解它们的名称;过氧化氢可在二氧化锰催化的条件下,在A装置中反应,生成氧气;
②装置E代替装置B收集氧气,根据氧气的密度分析进气口.
(3)[查阅资料]根据质量守恒定律确定产物中一定不存在氯化镁;
[提出猜想]根据空气的成分和固体的颜色判断淡黄色固体的来源;
[实验探究]根据在纯氧气中燃烧镁条只生成白色固体,在纯氮气中燃烧镁条只生成淡黄色色固体,可采取在纯纯氮气中燃烧镁条,观察现象的方法;
[实验结论]根据反应的反应物、生成物和反应条件书写方程式;
[反思与评价]根据镁可以在氮气中燃烧这一特殊性质分析回答.
点评:正确理解质量守恒定律的内容,了解燃烧的定义及定义的拓展意义是解决问题的关键,书写化学方程式一定要确定反应物和生成物的化学式.

练习册系列答案
相关题目
(1)正确的实验操作是确保实验成功和安全的前提.试回答:
①量液时,量筒必须放平,视线 .
②用漏斗过滤时,注意漏斗中液体的液面始终要 .
③点燃可燃性的气体如H2前要 .
(2)如图是初中化学学习中的常见装置,请按要求回答下面问题:

①写出标有序号的仪器的名称:Ⅰ Ⅱ 利用上述装置的组合可以制取氧气,写出有关反应的符号表达式 .
②若用装置E代替装置B收集氧气,氧气应从 (选填“a”或“b”)端导入.
(3)小明同学在空气中点燃镁条时,却发现在生成的白色固体氧化镁中还夹杂着少量的淡黄色固体.
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小明查阅资料,记录了下列几种物质的颜色:
小聪同学认为不必查阅氯化镁的颜色,生成物中一定不可能含有氯化镁.小聪的理由是 .
[提出猜想]分析资料,小明认为淡黄色固体可能是镁与空气中的 反应生成的.
[实验探究]小明设计实验证实了自己的猜想,他的方案可能是 .
[实验结论]根据小明实验结果,写出镁条在空气中燃烧的两个反应的符号表达式: ; .
[反思与评价]
①通过此实验的现象,得出镁更易和空气中的 起反应.
②通过上述实验,得出燃烧 (选填“一定”或“不一定”)要有氧气参加.
③小明点燃镁条后生成的固体中镁元素的质量分数 (选填“>”或“=”或“<”)60%.
①量液时,量筒必须放平,视线 .
②用漏斗过滤时,注意漏斗中液体的液面始终要 .
③点燃可燃性的气体如H2前要 .
(2)如图是初中化学学习中的常见装置,请按要求回答下面问题:

①写出标有序号的仪器的名称:Ⅰ Ⅱ 利用上述装置的组合可以制取氧气,写出有关反应的符号表达式 .
②若用装置E代替装置B收集氧气,氧气应从 (选填“a”或“b”)端导入.
(3)小明同学在空气中点燃镁条时,却发现在生成的白色固体氧化镁中还夹杂着少量的淡黄色固体.
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小明查阅资料,记录了下列几种物质的颜色:
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出猜想]分析资料,小明认为淡黄色固体可能是镁与空气中的 反应生成的.
[实验探究]小明设计实验证实了自己的猜想,他的方案可能是 .
[实验结论]根据小明实验结果,写出镁条在空气中燃烧的两个反应的符号表达式: ; .
[反思与评价]
①通过此实验的现象,得出镁更易和空气中的 起反应.
②通过上述实验,得出燃烧 (选填“一定”或“不一定”)要有氧气参加.
③小明点燃镁条后生成的固体中镁元素的质量分数 (选填“>”或“=”或“<”)60%.