题目内容
【题目】漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应.Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.
(1)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH(填“增大”或“减小”或“不变”).
(2)在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式 .
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验. 【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3 .
【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, | 有气体产生, | 猜想2成立 |
②在上述反应后试管中加少量 |
(4)现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案: 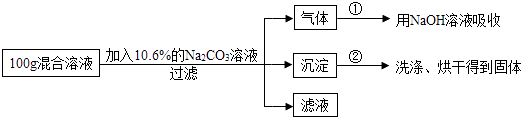
【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
①m=
②上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?(不考虑过滤中的损失,计算结果保留到小数点后一位.)
【答案】
(1)减少
(2)Ca(ClO)2+2HCl=CaCl2+2HClO
(3)CaCl2、Ca(ClO)2、CaCO3;加入足量的稀盐酸,塞上带导管的单孔塞,把导管插入另一盛有澄清石灰水的试管中;品红溶液;品红溶液褪色
(4)200;经过滤后所得“滤液”中溶质的质量分数为: ![]() ×100%=8.2%, 答:过滤后所得“滤液”中溶质的质量分数为8.2%
×100%=8.2%, 答:过滤后所得“滤液”中溶质的质量分数为8.2%
【解析】解:(1)某瓶HClO溶液放置一段时间后,次氯酸分解生成了盐酸,溶液的酸性增强,pH减小. 故填:减小.(2)漂白粉中的次氯酸钙和稀盐酸反应生成氯化钙和次氯酸,加入盐酸反应的化学方程式为:Ca(ClO)2+2HCl=CaCl2+2HClO.
故填:Ca(ClO)2+2HCl=CaCl2+2HClO.(3)【猜 想】
猜想1:该漂白粉未变质,成分不变,因此固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,一部分次氯酸钙和空气中的水、二氧化碳反应生成了碳酸钙,因此固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,全部的次氯酸钙和空气中的水、二氧化碳反应生成了碳酸钙,因此固体成分为CaCl2、CaCO3 .
故填:CaCl2、Ca(ClO)2、CaCO3 .
【实验探究】实验方案如下表所示:
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的稀盐酸,塞上带导管的单孔塞,把导管插入另一盛有澄清石灰水的试管中 | 有气体产生, | 猜想2成立 |
②在上述反应后试管中加少量品红溶液 | 品红溶液褪色 |
;(4)【实验数据】(1)设和稀盐酸反应的碳酸钠质量为x,生成的氯化钠质量为y,和氯化钙反应的碳酸钠质量为m,反应生成的氯化钠质量为n,
Na2CO3+2HCl= | 2NaCl+H2O+ | CO2↑ | Na2CO3+CaCl2= | CaCO3↓+ | 2NaCl |
106 | 117 | 44 | 106 | 100 | 117 |
x | y | 4.4g | m | 10g | n |
![]() =
= ![]() =
= ![]() ,
, ![]() =
= ![]() =
= ![]() ,
,
x=10.6g,y=11.7g,m=10.6g,n=11.7g,
碳酸钠溶液的质量为:(10.6g+10.6g)÷10.6%=200g,因此m=200,
故填:200.(2)经过滤后所得“滤液”中溶质的质量分数为: ![]() ×100%=8.2%
×100%=8.2%
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案