题目内容
金属材料在生产、生活中有着广泛的应用,因此正确认识金属材料具有重要意义.
(1)截止目前为止,人们使用最多的金属材料是________.
(2)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
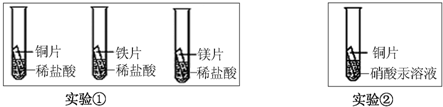
根据实验①判断出镁的金属活动性比铁强,依据的现象是________;
根据实验②的现象应得出的结论是________.
(3)氧化铝是一种重要的金属氧化物.新制得的氧化铝除能与盐酸等发生化学反应外,还能与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水.因此化学上把氧化铝称为两性氧化物.
请结合上面信息写出氧化铝与氢氧化钠溶液反应的化学方程式:________.
(4)在今年开展的“我与化学”活动中,有同学采用将铁粉在空气中洒向火盆里,结果发现也有火星四射的现象产生.因此论证了铁在空气中不能燃烧的结论是不够准确的.假设铁粉在空气中燃烧的产物和铁在纯氧气中燃烧的产物相同,请写出该反应的化学方程式:________,从铁丝在空气中不能燃烧,而铁粉在空气中却可以燃烧的事实中,你能得出的一个结论是________.
解:(1)截止目前为止,人们使用最多的金属材料是钢铁;
(2)①根据实验①判断出镁的金属活动性比铁强,依据的现象是镁与盐酸反应比铁剧烈;
②由实验②的现象铜的表面由汞生成,得出的结论是铜的金属活动性比汞强;
(3)氧化铝与氢氧化钠溶液反应成偏铝酸钠(NaAlO2)和水,化学方程式是:Al2O3+2NaOH=2NaAlO2+H2O;
(4)假设铁粉在空气中燃烧的产物和铁在纯氧气中燃烧的产物相同,该反应的化学方程式:3Fe+2O2 Fe3O4;铁丝在空气中不能燃烧,而铁粉在空气中却可以燃烧,铁丝的表面积小铁粉的表面积大,能得出的一个结论是:可燃物的表面积对能否燃烧有很大影响.
Fe3O4;铁丝在空气中不能燃烧,而铁粉在空气中却可以燃烧,铁丝的表面积小铁粉的表面积大,能得出的一个结论是:可燃物的表面积对能否燃烧有很大影响.
故答为:(1)钢铁;(2)①镁与盐酸反应比铁剧烈,或镁比铁反应快,②铜的金属活动性比汞强,或铜比汞活泼;
(3)Al2O3+2NaOH=2NaAlO2+H2O;(4)3Fe+2O2 Fe3O4 可燃物的表面积对能否燃烧有很大影响.
Fe3O4 可燃物的表面积对能否燃烧有很大影响.
分析:(1)根据人们使用金属材料的现状回答;
(2)①根据镁、铁与盐酸反应的剧烈程度分析;
②根据金属活动性顺序的应用分析;
(3)根据反应物、生成物及反应条件写出反应的方程式;
(4)根据反应写出方程式,根据铁丝与铁粉的表面积的大小分析影响反应速率的因素.
点评:本题主要考查了金属活动性顺序的应用,熟记金属活动性顺序,理解其应用是解题的关键.
(2)①根据实验①判断出镁的金属活动性比铁强,依据的现象是镁与盐酸反应比铁剧烈;
②由实验②的现象铜的表面由汞生成,得出的结论是铜的金属活动性比汞强;
(3)氧化铝与氢氧化钠溶液反应成偏铝酸钠(NaAlO2)和水,化学方程式是:Al2O3+2NaOH=2NaAlO2+H2O;
(4)假设铁粉在空气中燃烧的产物和铁在纯氧气中燃烧的产物相同,该反应的化学方程式:3Fe+2O2
 Fe3O4;铁丝在空气中不能燃烧,而铁粉在空气中却可以燃烧,铁丝的表面积小铁粉的表面积大,能得出的一个结论是:可燃物的表面积对能否燃烧有很大影响.
Fe3O4;铁丝在空气中不能燃烧,而铁粉在空气中却可以燃烧,铁丝的表面积小铁粉的表面积大,能得出的一个结论是:可燃物的表面积对能否燃烧有很大影响.故答为:(1)钢铁;(2)①镁与盐酸反应比铁剧烈,或镁比铁反应快,②铜的金属活动性比汞强,或铜比汞活泼;
(3)Al2O3+2NaOH=2NaAlO2+H2O;(4)3Fe+2O2
 Fe3O4 可燃物的表面积对能否燃烧有很大影响.
Fe3O4 可燃物的表面积对能否燃烧有很大影响.分析:(1)根据人们使用金属材料的现状回答;
(2)①根据镁、铁与盐酸反应的剧烈程度分析;
②根据金属活动性顺序的应用分析;
(3)根据反应物、生成物及反应条件写出反应的方程式;
(4)根据反应写出方程式,根据铁丝与铁粉的表面积的大小分析影响反应速率的因素.
点评:本题主要考查了金属活动性顺序的应用,熟记金属活动性顺序,理解其应用是解题的关键.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目

 (2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.
(2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.