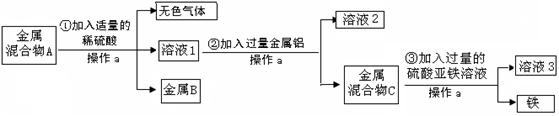
题目内容
(5分)纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.
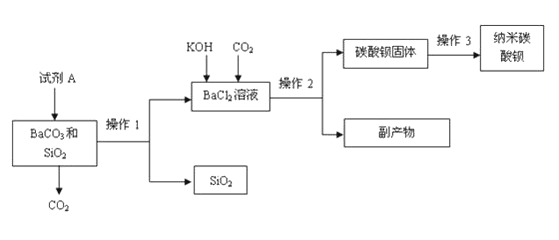
请回答下列问题:
(1)试剂A的化学式 ,若在实验室中进行该实验,操作1和操作2的名称是
(2)操作3为洗涤、检验和烘干,其中洗涤的作用是 ,检验洗涤是否干净可选用试剂
(3)上述流程中可循环利用的物质是

请回答下列问题:
(1)试剂A的化学式 ,若在实验室中进行该实验,操作1和操作2的名称是
(2)操作3为洗涤、检验和烘干,其中洗涤的作用是 ,检验洗涤是否干净可选用试剂
(3)上述流程中可循环利用的物质是
⑴ HCl 过滤
⑵ 除去沉淀表面的可溶性杂质 硝酸银溶液
⑶ CO2
⑵ 除去沉淀表面的可溶性杂质 硝酸银溶液
⑶ CO2
(1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;根据操作后得到溶液与固体,利用过滤操作的特点,可判断操作1、2均为过滤操作,
(2)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡间所发生的反应,判断副产物为碳酸钾,结合该物质的组成及性质,举例说明其用途;
(2)根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)根据可循环利用的物质的特点:既是某反应的生成物又是另外反应的反应物,利用流程图判断其中循环利用的物质;根据流程中所发生的反应,由氢氧化钾、二氧化碳、氯化钡间所发生的反应,判断副产物为碳酸钾,结合该物质的组成及性质,举例说明其用途;

练习册系列答案
相关题目
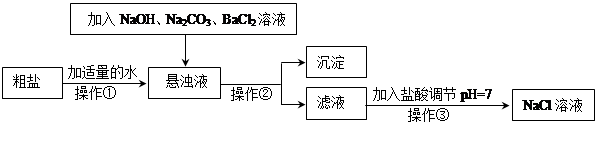 回答下列问题:
回答下列问题: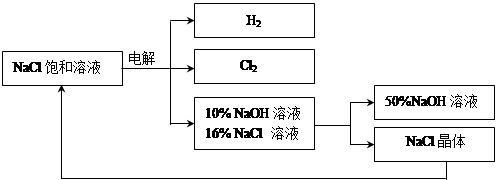
 Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)
Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)