题目内容
【题目】我市城区居民家用燃料的使用经历了以下发展历程(括号内表示主要成分),结合所学知识回答下列问题:
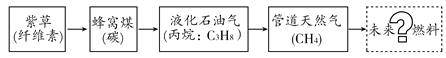
(1)柴草中纤维素的化学式为:(C6H10O5)n,其中“n”的含义是_____________________,纤维素在空气中完全燃烧的产物是_____________(填化学式)。
(2)20世纪八十年代前后,居民家中主要采用蜂窝煤作燃料,将煤炭加工成蜂窝煤的目的是_____ 。
(3)上述燃料的使用都能产生_____________(填化学式),温室效应增强。
(4)丙烷燃烧的微观示意图如下图所示:该反应中最小的粒子是_________(填化学符号);该反应的化学方程式为______________________________。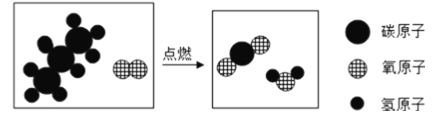
【答案】 每个纤维素分子中含有n个C6H10O5原子团 CO2和H2O 增加与氧气的接触面积 CO2 C、H、O C3H8+5O2 ![]() 3CO2+4H2O 。
3CO2+4H2O 。
【解析】本题考查了常用燃料的使用,质量守恒定律和微粒示意图的应用。
(1)柴草中纤维素的化学式为:(C6H10O5)n,其中“n”的含义是每个纤维素分子中含有n个C6H10O5)原子团;根据质量守恒定律,纤维素在空气中完全燃烧的产物是CO2和H2O;
(2)将煤炭加工成蜂窝煤的目的是增大煤与空气的接触面积,能够使其燃烧更充分;
(3)上述燃料的使用都能产生CO2,温室效应增强;
(4)化学反应前后原子的种类和数目不变,该反应前后不变的粒子是C、H、O;丙烷燃烧生成二氧化碳和水,反应的化学方程式为:C3H8+5O2 ![]() 3CO2+4H2O。
3CO2+4H2O。

【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。
【题目】过氧化纳(化学式为Na2O2)可用在呼吸面具中作为氧气来原, Na2O2能和CO2反应生成O2和另—种固体化合物 (用x表示)。
【掲出猜想】有同学猜想X可能是酸,碱性盐中的一种,通过对物质组成的分析大家一致认为X肯定不是酸和碱,理由是__________.
【设计方案】请完成下表
实验步骤 | 实验现象 | 实验结论 |
实验一:取少量X,滴加稀盐酸.将产生的气体通入澄清石灰水 | 有气泡产生___________ | X为Na2CO3 |
实验二.取少量 X,加水配成溶液, 滴加的溶液.该碱可是______ | 生成白色沉淀 |
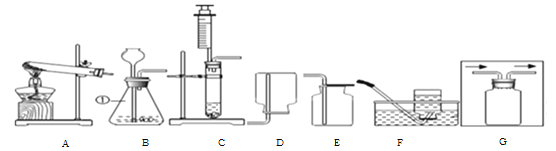
【拓展探究】用下图所示装置进行二氧化与过氧化钠(Na2O2)的反应。
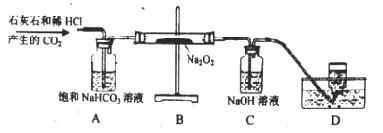
(1)装置A的作用是吸收CO2中混有的HCl, 装置C中反应的化学方程___________
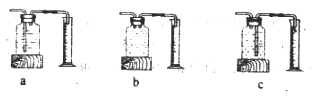
(2)测量装置D中收集的气体体积,可用下图中的__________进行收集。
(3)兴趣小组查阅资料发现Na2O2也用H2O反应生成NaOH和O2为探究反应后装置B中固体的成分,甲同学取固体于试管中,加足量水,无气抱产生,则固体中—定没有________将所得溶液分成两份,进行下表所示实验:
实验操作 | 实验现象 | 分析与结论 |
向一份溶液中滴加过量的稀HCL | 有气泡产生 | B中固体有Na2CO3 |
向另一份溶液中_____ | 溶液变红 | B中固体有NaOH |
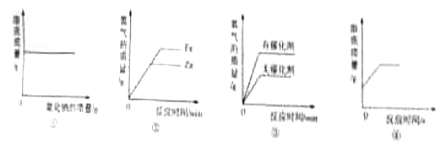
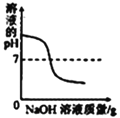
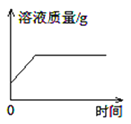
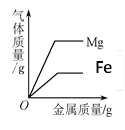
【题目】下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
A | B | C | D |
加水稀释氢氧化钠溶液 | 一定量的稀硫酸与镁条反应,溶液的质量与反应时间的关系 | 向两份完全相同的稀盐酸中分别加入足量铁粉、镁粉 | 等体积、等质量分数的过氧化氢溶液制取氧气 |
|
|
|
|
A. A B. B C. C D. D