题目内容
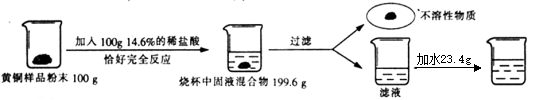
【题目】为了测定某含杂质5%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:
(1)配制上述质量分数为14.6%的稀盐酸,需质量分数为36.5%的浓盐酸质量是_ ;
(2)发生反应的化学方程式为___________________;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为_____ ;
(4)该黄铜样品中铜的质量分数是__________ ;
(5)向过滤后所得滤液中加入23.4g水,则最终所得溶液中溶质的质量分数是___ 。
【答案】(1)40g(2)Zn+2HCl=ZnC12+H2↑

(4)82%(5)20%
【解析】
试题分析:(1)稀释前后溶质的质量相等。设需质量分数为36.5%的浓盐酸质量是x,则100g × 14.6% = x × 36.5% 解得x=40g(2)铜位于金属活动性顺序中H的后面,不与稀盐酸反应,而锌位于H前,可以与稀盐酸反应,化学方程式是: Zn+ 2HCl=ZnC12+ H2↑(3)反应前反应物的总质量是:100 g+100 g=200 g,反应后烧杯中固液混合物的总质量是199.6 g,故生成氢气的质量是:200 g-199.6 g=0.4 g,设100g该黄铜样品中锌的质量为x
Zn+ 2HCl=ZnC12+ H2↑
65 2
X 0.4g
![]() =
=![]() 解得x=13g
解得x=13g
(4)该黄铜样品中Zn的质量是13 g,铜的质量分数是[100g×(1-5%)-13g]÷100g=85%
(5)设生成氯化锌的质量为y
Zn+ 2HCl=ZnC12+ H2↑
136 2
y 0.4g
![]() =
=![]() 解得y=27.2 g
解得y=27.2 g
最终所得溶液的质量是:13g+100g-0.4 +23.4g=136g
最终所得溶液的溶质质量分数是:![]() ×100%=20%
×100%=20%

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案