题目内容
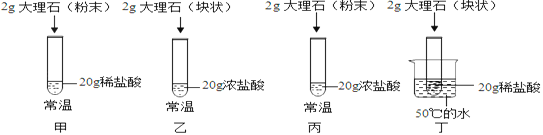
【题目】某兴趣小组同学阅读课外资料得知:很多因素都能影响化学反应速度。于是,兴趣小组探究了影响大理石与稀盐酸反应剧烈程度的因素。
(查阅资料)浓盐酸是一种具有挥发性的液体,反应物的浓度越大,反应速率越快。
(实验过程)(注:盐酸足量)
(实验分析)
(1)为了检验产生的气体是否为二氧化碳,请你写出检验的方法:_______ (用化学方程式表示);
(2)若要探究盐酸浓度大小对反应的影响,可选择实验甲与_______对照(选填实验编号);
(3)除盐酸浓度大小外,上述实验研究的另两个影响反应的因素是________和_________。
(实验结论)
上述实验中反应的化学方程式是______________。
(交流讨论)与甲比较,对丙的分析,错误的是_______(选填编号)。
A、反应更为剧烈 B、试管中最终剩余液体的质量更小
C、产生的二氧化碳的质量更大 D、粉末状大理石利用率更高
【答案】Ca(OH)2 + CO2 = CaCO3↓ + H2O 丙 温度 反应物颗粒大小(反应物之间接触面积大小) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ CD
【解析】
实验
(1)检验二氧化碳用澄清的石灰水,实验原理为二氧化碳和氢氧化钙反应生成碳酸钙和水,反应的化学方程式为:Ca(OH)2 + CO2 = CaCO3↓ + H2O;
(2)若要探究盐酸浓度大小对反应的影响,当选择实验甲时,对应的对照实验,需要选择同样的常温下,同样的颗粒状态(粉末状),唯一不同的是盐酸的浓度,所以只能选择丙对照;
(3)上述实验中,甲和丙对比探究了盐酸浓度大小的影响,甲和丁对比探究了温度高低对实验的影响,乙和丙对比探究了颗粒大小(也就是反应物直接接触面积大小)对反应的影响,综合以上分析,上述实验研究的另两个影响反应的因素是温度和反应物颗粒大小(反应物之间接触面积大小);
实验结论:
上述实验中,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,对应的化学方程式是 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;
交流讨论:
A、甲和丙的对比,两者碳酸钙质量相同,状态相同,温度相同,丙盐酸浓度高,所以丙反应更剧烈,故A正确;
B、试管中最终剩余液体的质量取决于逸出试管外的气体质量,浓盐酸易挥发,所以丙中得到的二氧化碳混有的HCl杂质相对较多,因此剩余溶液的质量会更小,故B正确;
C、当两种盐酸都过量时,生成的二氧化碳的质量取决于碳酸钙的质量,两者碳酸钙质量相同,因此生成的二氧化碳质量可能相同,故C错误;
D、碳酸钙的利用效率相同,粉末状大理石反应速度比块状大理石快,故D错误。故选CD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验。
查阅资料:烧碱固体有吸水性且能与二氧化碳发生反应。
无水硫酸铜遇水会由白色变成蓝色。
①制备氧化铜并检验产物,装置如图所示(省略夹持仪器):
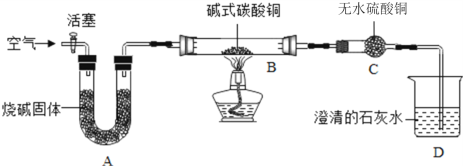
步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D开始加热。观察到C中固体变蓝,D中澄清石灰水变浑浊。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
加热时间(min) | 0 | t1 | t2 | t3 |
B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
①B中发生反应的化学方程式为:__________ , A的作用是吸收空气中的_______,防止对产物检验造成干扰。选择t3时停止加热的理由是____________。
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如图所示:写出该反应的化学方程式________,实验过程中,观察到F中溶液变浑浊,E中的现象是___________反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是____________
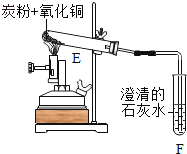
③若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因______________。
④计算②反应后理论上可制得多少克铜__________。