题目内容
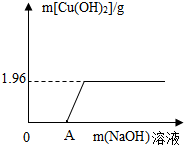 某环保小组监测到一工厂向河中排放的酸性废液中含有CuCl2.为了测定废液中CuCl2的质量分数.该小组取了100g废液,逐滴滴入NaOH溶液至过量.测得生成Cu(OH)2沉淀与所加NaOH溶液的质量关系如图.
某环保小组监测到一工厂向河中排放的酸性废液中含有CuCl2.为了测定废液中CuCl2的质量分数.该小组取了100g废液,逐滴滴入NaOH溶液至过量.测得生成Cu(OH)2沉淀与所加NaOH溶液的质量关系如图.(1)计算废液中CuCl2的质量分数
(2)说明图上OA段未生成Cu(OH)2沉淀的原因:
分析:氯化铜溶液与氢氧化钠溶液混合时生成氢氧化铜沉淀和硫酸钠;
(1)根据质量关系图,当所加氢氧化钠溶液与硫酸铜溶液恰好完全反应时,生成沉淀氢氧化铜的质量为1.96g;利用生成的氢氧化铜的质量根据反应的化学方程式可计算中废液中氯化铜的质量;
(2)废液为酸性溶液,而氢氧化钠与酸发生中和反应,待将废液中的酸完全中和后才能与氯化铜生成氢氧化铜沉淀.
(1)根据质量关系图,当所加氢氧化钠溶液与硫酸铜溶液恰好完全反应时,生成沉淀氢氧化铜的质量为1.96g;利用生成的氢氧化铜的质量根据反应的化学方程式可计算中废液中氯化铜的质量;
(2)废液为酸性溶液,而氢氧化钠与酸发生中和反应,待将废液中的酸完全中和后才能与氯化铜生成氢氧化铜沉淀.
解答:解:(1)设废液中CuCl2的质量为x
CuCl2+2NaOH=2NaCl+Cu(OH)2↓
135 98
x 1.96g
=
x=2.7g
废液中CuCl2的质量分数为:
×100%=2.7%
答:废液中CuCl2的质量分数为2.7%;
(2)溶液呈酸性时,氢氧化钠不能与氯化铜反应生成氢氧化铜沉淀,所以,一开始滴加氢氧化钠溶液时并不能生成氢氧化铜沉淀;待溶液中的酸与氢氧化钠溶液完全反应后,继续滴加的氢氧化钠溶液与氯化铜反应产生沉淀;
故答案为:滴入的NaOH先与废液中的酸产生反应.
CuCl2+2NaOH=2NaCl+Cu(OH)2↓
135 98
x 1.96g
| 135 |
| x |
| 98 |
| 1.96g |
废液中CuCl2的质量分数为:
| 2.7g |
| 100g |
答:废液中CuCl2的质量分数为2.7%;
(2)溶液呈酸性时,氢氧化钠不能与氯化铜反应生成氢氧化铜沉淀,所以,一开始滴加氢氧化钠溶液时并不能生成氢氧化铜沉淀;待溶液中的酸与氢氧化钠溶液完全反应后,继续滴加的氢氧化钠溶液与氯化铜反应产生沉淀;
故答案为:滴入的NaOH先与废液中的酸产生反应.
点评:化学变化与数学图形的结合类问题,图形中所出现的拐点为表示恰好完全反应.

练习册系列答案
相关题目
 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.

