题目内容
【题目】一包不纯的氯化钾粉末,所含杂质可能是氯化钠、硝酸钾、硝酸钙、氯化铜、碳酸钠中的一种或几种。为确定其成分,某兴趣小组的同学们进行如下实验:(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。(3)另称取7.45 g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成14.35g白色沉淀。根据上述实验判断,下列说法正确的是
A. 杂质中可能含有硝酸钾、氯化钠
B. 杂质中肯定不含硝酸钙、氯化铜、碳酸钠
C. 杂质中肯定含有碳酸钠,可能含有氯化钠
D. 杂质中肯定含有氯化钠、碳酸钠,可能含有硝酸钾
【答案】D
【解析】
(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液,所以原固体中不含氯化铜,碳酸钠与硝酸钙只能有一种。
(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成,说明所固体中有碳酸钠,没有硝酸钙。
(3)另称取7.45 g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成14.35g白色沉淀。根据化学反应方程式:
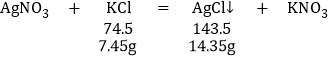
因为氯化钾是不纯的,又根据实验分析知一定含碳酸钠,而氯化钠的相对分子质量为:58.5,其中氯元素的质量分数比氯化钾大,所以也一定有氯化钠,而硝酸钾则可能有。故选D。

 探究与巩固河南科学技术出版社系列答案
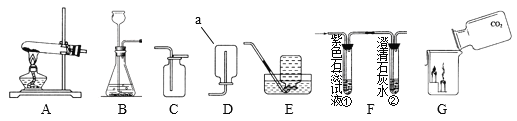
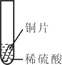
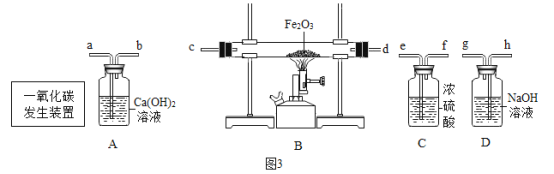
探究与巩固河南科学技术出版社系列答案【题目】实验室部分装置如图所示,请回答下列问题:
(1)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液,MnO2 | ____ | ____ |
KMnO4 | ____ |
(2)如果用加热浓氨水(NH3·H2O)制备氨气(NH3),可选用的发生装置是______(填字母)。
(3)选用F装置收集气体时,下列实验操作不正确的是_________(填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中;
②开始反应后,有气泡排出时,将导管口移入集气瓶;
③收集气体后,将集气瓶盖上玻璃片再移出水槽。
(4)实验室用KC1O3和MnO2制备O2的化学方程式是______。
【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。
【题目】小明同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小明想探 究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
(知识回放)
金属活动性顺序:K Ca Na Mg Al Zn_____Sn Pb(H)_____Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
(作出猜想)
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是_______。
(查阅资料)
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(设计与实验)
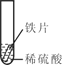
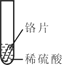
小明同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
实验 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | _________ |
(结论与解释)
(1)小明得到的结论是猜想_______正确。
(2)实验前用砂纸打磨金属片的目的是________________。
(知识运用)
请你写出铬与稀硫酸反应的化学方程式____________。
【题目】某兴趣小组在常温和其它相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口放置于空气中,烧杯中物质质量随时间变化如下表,请回答下列问题。
时间 | 质量/g | |||||
水 | 饱和石灰水 | 稀盐酸 | 浓硫酸 | 氯化钠浓溶液 | 氯化钙浓溶液 | |
1天 | 8.16 | 8.37 | 8.64 | 11.18 | 9.38 | 10.25 |
2天 | 5.76 | 5.94 | 6.69 | 12.25 | 8.47 | 10.33 |
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是______(填字母编号)。图中![]() 表示氧原子,
表示氧原子,![]() 表示氢原子
表示氢原子
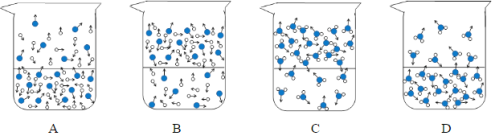
(2)为研制一种安全、环保的除湿剂,可选择上表中的(填溶质的化学式)____。
(3)现配置100g 20%的稀硫酸,则需要质量分数为98%(密度为1.84g/cm3)的浓硫酸____ml。(结果保留整数)
(4)为进一步研究稀盐酸敞口久置后浓度变化,其中甲同学猜想稀盐酸浓度可能会变大,理由是_____。