题目内容
现有氢气、氧气的混合气体40g,装入密闭容器中,点燃反应后,测得生成水的质量为36g,则原混合物中氢气、氧气的质量分别为
- A.氢气10g,氧气10g
- B.氢气32g,氧气8g
- C.氢气8g,氧气32g
- D.氢气4g,氧气36g
CD
分析:分析题意可知,反应后物质质量小于反应前物质质量,说明反应物有剩余.如果氢气完全反应,则氧气有剩余;如果氧气完全反应,则氢气有剩余.利用化学方程式计算即可.
解答:①假设氧气完全反应,设氧气的质量为x,
2H2+O2 2H2O
2H2O
32 36
x 36g
∴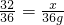 ,
,
解之得:x=32g,
则氢气的质量为:40g-32g=8g;
②假设氢气完全反应,设氢气的质量为y,
2H2+O2 2H2O
2H2O
4 36
y 36g
∴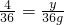 ,
,
解之得:y=4g,
则氧气的质量为:40g-4g=36g.
所以原混合物中氢气质量为4g,氧气的质量为36g;
原混合物中氢气质量为8g,氧气的质量为32g.
故选CD.
点评:本题主要考查学生利用化学方程式进行计算的能力.学生需全面考虑出现的情况,才能正确解答.
分析:分析题意可知,反应后物质质量小于反应前物质质量,说明反应物有剩余.如果氢气完全反应,则氧气有剩余;如果氧气完全反应,则氢气有剩余.利用化学方程式计算即可.
解答:①假设氧气完全反应,设氧气的质量为x,
2H2+O2
 2H2O
2H2O32 36
x 36g
∴
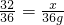 ,
,解之得:x=32g,
则氢气的质量为:40g-32g=8g;
②假设氢气完全反应,设氢气的质量为y,
2H2+O2
 2H2O
2H2O4 36
y 36g
∴
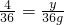 ,
,解之得:y=4g,
则氧气的质量为:40g-4g=36g.
所以原混合物中氢气质量为4g,氧气的质量为36g;
原混合物中氢气质量为8g,氧气的质量为32g.
故选CD.
点评:本题主要考查学生利用化学方程式进行计算的能力.学生需全面考虑出现的情况,才能正确解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有氢气、氧气的混合气体40g,装入密闭容器中,点燃反应后,测得生成水的质量为36g,则原混合物中氢气、氧气的质量分别为( )
| A、氢气10g,氧气10g | B、氢气32g,氧气8g | C、氢气8g,氧气32g | D、氢气4g,氧气36g |
现有氢气和氧气的混合气体共4g,点燃使其充分反应后,剩余气体0.4g.则原混合气体中氧气的质量可能是( )
| A、3.6g | B、3.2g | C、2.4g | D、0.8g |