题目内容
【题目】如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.请回答下列问题: 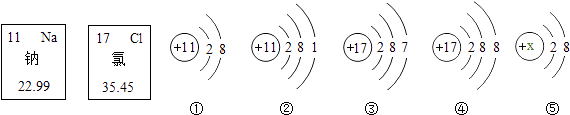
(1)氯元素原子的质子数是;钠元素与氯元素的最本质区别是;在元素周期表中,钠元素和氯元素位于(选填序号).
A.同一周期 B.不同周期 C.同一族 D.不同族
(2)上图①②③④四种粒子中,表示钠原子的是(选填序号,下同);构成氯化钠的粒子是 . 钠与氯气反应,每个得到1个电子.
(3)若⑤表示Mg2+ , 则x= , 那么④和⑤相互作用形成的化合物的化学式是 .
【答案】
(1)17;质子数不同;AD
(2)②;①④;③
(3)12;MgCl2
【解析】解:(1)根据元素周期表中的一个小格所提供的信息可查得氯元素的原子序数为17;元素是具有相同核电荷数(即质子数)的一类原子的总称,不同元素之间的本质区别是质子数不同;由元素周期表的结构知,因钠原子和氯原子具有相同的电子层数,因此钠元素和氯元素位于同一周期,不在同一族.所以答案是:17;质子数不同;AD;(2)钠是11号元素,其原子核内有11个质子,核外有11个电子,因此②表示钠原子;氯化钠是由钠离子和氯离子构成的,而①④分别是钠离子和氯离子;由氯原子结构示意图知最外层有7个电子,易得1个电子形成稳定结构;所以答案是:②;①④;③;(3)若⑤表示Mg2+ , 则x=2+8+2=12;镁、氯两种元素组成的化合物的化学式为MgCl2 . 所以答案是:12;MgCl2 .

练习册系列答案
相关题目