题目内容
氧化物、酸、碱、盐相互之间的关系是初中化学学科中重要学习内容之一.现有如下所示的转换关系:
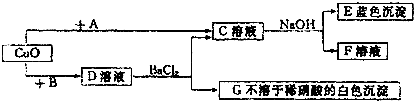
(1)请写出A物质的化学式
(2)写出CuO与B反应的化学方程式
(3)某同学用湿润的pH试纸测得D溶液的pH为6,该同学的操作正确吗?

(1)请写出A物质的化学式
HCl
HCl
,G物质的化学式BaSO4
BaSO4
.(2)写出CuO与B反应的化学方程式
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
.(3)某同学用湿润的pH试纸测得D溶液的pH为6,该同学的操作正确吗?
否
否
,若不正确则D溶液的pH<
<
6(填“>”,“<”或“=”)分析:(1)根据C中加入氢氧化钠蓝色沉淀判断E为氢氧化铜,C为可溶性铜盐,根据C的种类和氧化铜的性质判断A为酸,D溶液中加入氯化钡生成不溶于硝酸的白色沉淀,说明G为硫酸钡,D中含有硫酸根,则B为硫酸;结合推知C,再推导A.
(2)根据氧化铜与硫酸反应的性质书写方程式.
(3)根据测pH的方法分析解答.
(2)根据氧化铜与硫酸反应的性质书写方程式.
(3)根据测pH的方法分析解答.
解答:解:(1)D溶液中加入氯化钡生成不溶于硝酸的白色沉淀,说明G为硫酸钡或氯化银,根据D的来源,D中不可能含有银离子,故必含有硫酸根,为可溶性的硫酸盐;又因是氧化铜与B反应生成的,故D为硫酸铜,B为硫酸;硫酸铜与氯化钡反应生成硫酸钡和氯化铜,故C为氯化铜;氯化铜与氢氧化钠反应能生成蓝色的氢氧化铜沉淀和氯化钠,则E为氢氧化铜,F为氯化钠;氧化铜与A反应生成氯化铜,则A 为盐酸.
(2)B为硫酸,氧化铜与硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O
(3)测溶液的pH不能将pH试纸湿润,会使测量值有误差,硫酸铜溶液呈酸性,用水将pH试纸湿润后使pH值偏大,所以测得D溶液的pH应小于6
故答案为:(1)HCl; BaSO4(2)CuO+H2SO4=CuSO4+H2O (3)否;<
(2)B为硫酸,氧化铜与硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O
(3)测溶液的pH不能将pH试纸湿润,会使测量值有误差,硫酸铜溶液呈酸性,用水将pH试纸湿润后使pH值偏大,所以测得D溶液的pH应小于6
故答案为:(1)HCl; BaSO4(2)CuO+H2SO4=CuSO4+H2O (3)否;<
点评:物质的推断是初中化学的难重点,也是中考的热点之一,了解物质的性质是解题的前提条件,解题时还要注意前后步骤间的联系,充分利用综合归纳法得出完整合理的结论.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
 22、象征着“和平、友谊、进步”的奥运会五环旗同学们都非常熟悉.如图“五环旗”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:
22、象征着“和平、友谊、进步”的奥运会五环旗同学们都非常熟悉.如图“五环旗”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答: 下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:
下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:
 9、下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:
9、下图“五连环”中的每一环表示一种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题: