题目内容
(2010?溧水县一模)A~J分别为初中化学常见的不同纯净物,它们存在下图所示的转化关系.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液呈蓝色,I是黑色固体.常温下B、D、F、J均为无色气体,其中B是有毒气体,J是一种具有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝.(反应②、④的个别生成物已略去)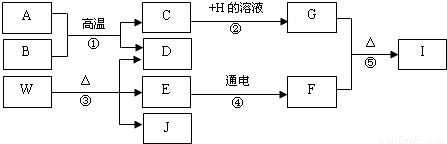
(1)写出E、J代表的物质的化学式:E,J.
(2)化合物W的组成元素是:.
(3)写出反应②的化学方程式:;
写出反应⑤的化学方程式:.
【答案】分析:本题的突破口有以下几处:
由A为铁锈的主要成分可知A为Fe2O3;由J是一种具有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝,可确定J为氨气NH3;
由E在常温下为无色液体,结合转化关系框图E在通电条件下生成气体F,可猜想E为水H2O;
由B是有毒气体,结合转化关系框图在高温条件下能与Fe2O3发生反应,可猜想B为一氧化碳CO;
由H的溶液呈蓝色,可猜想H为可溶性铜盐,常见的为硫酸铜CuSO4;
通过对上述物质的判断和猜测,结合转化关系图及文字信息的描述,可展开对其它物质或反应的推断.
解答:解:(1)E在常温下为无色液体,且在通电条件下生成气体F,可推断E为水H2O;J是一种具有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝,可确定J为氨气NH3;
故答案为:H2O;NH3;
(2)根据转化关系,A物质Fe2O3与B物质CO在高温条件下生成C和气体D,则可判断C为铁Fe、D为气体二氧化碳CO2;而物质W在加热条件下分解生成CO2、H2O、NH3,则W为碳酸氢铵NH4HCO3;
故答案为:C、H、O、N;
(3)C为铁、溶液H为可溶性铜盐的蓝色溶液,最常见的为硫酸铜溶液;因此反应②为铁置换硫酸铜中的铜生成硫酸亚铁;
故答案为:Fe+CuSO4=Cu+FeSO4;
气体F为水电解所产生的气体,可能为氧气或氢气;而G为铁与硫酸铜反应的生成物,可能为铜或硫酸亚铁;结合转化关系图,F和G能在加热条件下生成黑色固体I,则可确定反应⑤为铜与氧气在加热条件下生成黑色氧化铜;
故答案为:2Cu+O2?2CuO.
点评:根据物质的颜色、状态、气味等重要性质及主要成分的分析,找出特殊物质,形成对推断的突破,然后利用转化关系等进行合理地推断,从而梳理出解决问题的思路.
由A为铁锈的主要成分可知A为Fe2O3;由J是一种具有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝,可确定J为氨气NH3;
由E在常温下为无色液体,结合转化关系框图E在通电条件下生成气体F,可猜想E为水H2O;
由B是有毒气体,结合转化关系框图在高温条件下能与Fe2O3发生反应,可猜想B为一氧化碳CO;
由H的溶液呈蓝色,可猜想H为可溶性铜盐,常见的为硫酸铜CuSO4;
通过对上述物质的判断和猜测,结合转化关系图及文字信息的描述,可展开对其它物质或反应的推断.
解答:解:(1)E在常温下为无色液体,且在通电条件下生成气体F,可推断E为水H2O;J是一种具有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝,可确定J为氨气NH3;
故答案为:H2O;NH3;
(2)根据转化关系,A物质Fe2O3与B物质CO在高温条件下生成C和气体D,则可判断C为铁Fe、D为气体二氧化碳CO2;而物质W在加热条件下分解生成CO2、H2O、NH3,则W为碳酸氢铵NH4HCO3;
故答案为:C、H、O、N;
(3)C为铁、溶液H为可溶性铜盐的蓝色溶液,最常见的为硫酸铜溶液;因此反应②为铁置换硫酸铜中的铜生成硫酸亚铁;
故答案为:Fe+CuSO4=Cu+FeSO4;
气体F为水电解所产生的气体,可能为氧气或氢气;而G为铁与硫酸铜反应的生成物,可能为铜或硫酸亚铁;结合转化关系图,F和G能在加热条件下生成黑色固体I,则可确定反应⑤为铜与氧气在加热条件下生成黑色氧化铜;
故答案为:2Cu+O2?2CuO.
点评:根据物质的颜色、状态、气味等重要性质及主要成分的分析,找出特殊物质,形成对推断的突破,然后利用转化关系等进行合理地推断,从而梳理出解决问题的思路.

练习册系列答案
相关题目
(2010?溧水县一模)【提出问题】该厂附近所降雨水是否是酸雨?空气里SO2是否超标呢?
【查阅资料】Ⅰ.我国关于SO2在风景区、居民区、工厂区的空气质量最高标准分别见下表:
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应),但碳酸钡能溶于酸.
【设计实验1】第一组同学取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
所降雨水______(选填“是”或“不是”)酸雨.
【设计实验2】第二小组同学设计以下步骤来测定空气中SO2的含量.
(1)用2L的空可乐瓶采集工厂附近的空气样品.采样的具体操作是:______.
(2)向取回的装有2L空气样品的可乐瓶中加入NaOH溶液(假设在加入溶液的过程中,瓶中气体不会向外逸出),盖紧瓶塞后充分振荡.仿照CO2与NaOH溶液的反应,写出SO2与NaOH溶液反应的化学方程式:______.
(3)加入一定量氧化剂H2O2,使其中Na2SO3完全转化为Na2SO4.向可乐瓶中加入过量的BaCl2溶液.Na2SO4和BaCl2反应的化学方程式为:______.
(4)经过过滤、洗涤、烘干,称量固体质量为1.165mg.
计算:1.165mg硫酸钡中硫元素的质量为______mg.
由质量守恒定律可知,2L空气样品中SO2的质量为______mg.
由空气质量标准可得出结论:该厂排放的SO2严重超标.
【发现新问题】考虑到空气中的各种气体成分,第一组认为第二组同学的SO2的含量偏大,其依据是______;
你提出的实验改进方案是______.
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议:______.
【查阅资料】Ⅰ.我国关于SO2在风景区、居民区、工厂区的空气质量最高标准分别见下表:
| 级 别 | Ⅰ | Ⅱ | Ⅲ |
| SO2一小时测定平均含量(mg/m3) | 0.15 | 0.5 | 0.7 |
【设计实验1】第一组同学取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.95 | 4.91 | 4.88 | 4.86 | 4.85 | 4.85 |
【设计实验2】第二小组同学设计以下步骤来测定空气中SO2的含量.
(1)用2L的空可乐瓶采集工厂附近的空气样品.采样的具体操作是:______.
(2)向取回的装有2L空气样品的可乐瓶中加入NaOH溶液(假设在加入溶液的过程中,瓶中气体不会向外逸出),盖紧瓶塞后充分振荡.仿照CO2与NaOH溶液的反应,写出SO2与NaOH溶液反应的化学方程式:______.
(3)加入一定量氧化剂H2O2,使其中Na2SO3完全转化为Na2SO4.向可乐瓶中加入过量的BaCl2溶液.Na2SO4和BaCl2反应的化学方程式为:______.
(4)经过过滤、洗涤、烘干,称量固体质量为1.165mg.
计算:1.165mg硫酸钡中硫元素的质量为______mg.
由质量守恒定律可知,2L空气样品中SO2的质量为______mg.
由空气质量标准可得出结论:该厂排放的SO2严重超标.
【发现新问题】考虑到空气中的各种气体成分,第一组认为第二组同学的SO2的含量偏大,其依据是______;
你提出的实验改进方案是______.
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议:______.
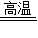 CaO+CO2↑; Mg(CO3)2
CaO+CO2↑; Mg(CO3)2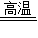 MgO+2CO2↑
MgO+2CO2↑