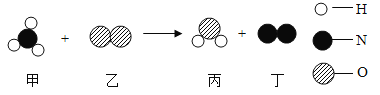
题目内容
【题目】图中A~H为初中化学常见的物质,A是大理石的主要成分;H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;G、E、H均为单质,且E可以被磁铁吸引;C、D、E中含有同一种金属元素;F、D中只含有一种相同的非金属元素。图中“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略。(已知MO+2HCl=MCl2+H2O,M表示某金属元素)
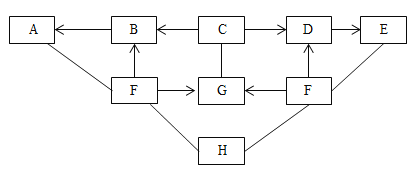
(1)A的名称是________;G的化学式是________
(2)写出D与H反应生成E的化学方程式___________________
(3)写出F与H反应的化学方程式_______________________
【答案】碳酸钙 H2 ![]()
![]()
【解析】
A~H为初中化学常见的物质,A是大理石的主要成分,可推出A为碳酸钙,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,且H为单质,可推出H为铝,G、E均为单质,且E可以被磁铁吸引,可推出E为铁,C、D、E中含有同一种金属元素,则含有铁元素;F能与碳酸钙、铝、铁反应反应,则F为酸,F、D中只含有一种相同的非金属元素,且F能转化为D,D能转化为F,可推出F为盐酸,D为氯化亚铁,盐酸能转化为B,B能转化为碳酸钙,可推出B为二氧化碳,C能转化为二氧化碳、氯化亚铁,且C含铁元素,可推出C为FeO;盐酸、铝都能转化为G,G能与FeO反应,可推出G为氢气,代入验证,符合题意。
(1)由分析可知,A为碳酸钙;G为氢气,化学式为:H2;
(2)D与H反应生成E为氯化亚铁与铝反应生成氯化铝和铁,该反应的化学方程式为:![]() ;
;
(3)F与H反应为铝与稀盐酸反应生成氯化铝和氢气,该反应的化学方程式为:![]()

 优加精卷系列答案
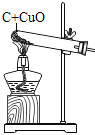
优加精卷系列答案【题目】现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):
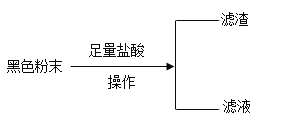
(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
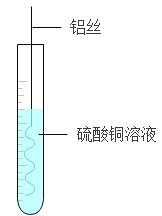
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)