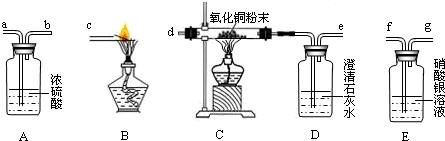
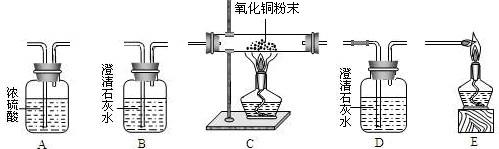
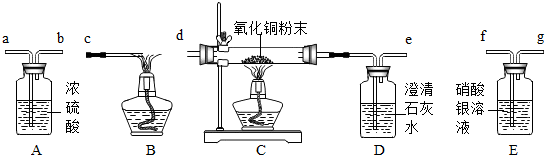
题目内容
现有一混合气体,其主要成分为CO,含有少量的水蒸气,可能含有少量CO2.某化学课题组的同学欲用该混合气体进行系列实验:①检验CO2气体是否存在,并除去CO2气体②用干燥纯净的CO气体还原的氧化铁
③实验CO气体还原氧化铁生成的气体生成物的性质
试用下图所示的仪器组装一套实验装置,完成上述实验任务.
请回答下列问题:
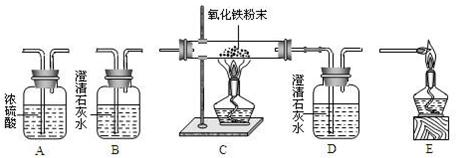
(1)实验进行时,若要气体从左向右流动,则这几种仪器组件的连接顺序应是:
(2)仪器B的作用是
(3)仪器C中能观察到的明显的实验现象是
(4)仪器D中发生反应的化学方程式为
(5)反应进行完全后,若装置C中被加玻璃管内固体质量减少a g,则生成的铁的质量是
(6)若没有仪器E,则本实验造成的后果是
分析:由题意知仪器的装配和连接,要完成以下任务:①检验CO2气体是否存在,并除去CO2气体;②用干燥纯净的CO气体还原的氧化铁;③实验CO气体还原氧化铁生成的气体生成物的性质.所以:
(1)仪器连接顺序:检验二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铁→检验气体生成物的性质→除尾气.
(2)澄清石灰水的作用:检验并除去二氧化碳气体.
(3)实验CO气体还原氧化铁的现象:红色粉末逐渐变为黑色.
(4)因为:一氧化碳+氧化铁→铁+二氧化碳,此反应有二氧化碳生成,所以发生反应:Ca(OH)2+CO2═CaCO3↓+H2O.
(5)根据化学方程式和质量守恒定律,计算结果.
(6)已知“混合气体,其主要成分为CO”,尾气中一定还有一氧化碳,如果不处理,会污染空气.
(1)仪器连接顺序:检验二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铁→检验气体生成物的性质→除尾气.
(2)澄清石灰水的作用:检验并除去二氧化碳气体.
(3)实验CO气体还原氧化铁的现象:红色粉末逐渐变为黑色.
(4)因为:一氧化碳+氧化铁→铁+二氧化碳,此反应有二氧化碳生成,所以发生反应:Ca(OH)2+CO2═CaCO3↓+H2O.
(5)根据化学方程式和质量守恒定律,计算结果.
(6)已知“混合气体,其主要成分为CO”,尾气中一定还有一氧化碳,如果不处理,会污染空气.
解答:解:(1)由题意知仪器的装配和连接,要完成以下任务:①检验CO2气体是否存在,并除去CO2气体;②用干燥纯净的CO气体还原的氧化铁;③实验CO气体还原氧化铁生成的气体生成物的性质.所以:仪器连接顺序:检验二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铁→检验气体生成物的性质→除尾气.
(4)设生成的铁的质量是x.
3CO+Fe2O3=2Fe+3CO2 质量差
160 112 48
x a
=
x=
答:生成的铁的质量是
.
故答为:(1)B→A→C→D→E
(2)检验并除去二氧化碳气体
(3)红色粉末逐渐变为黑色
(4)Ca(OH)2+CO2═CaCO3↓+H2O
(5)
(6)尾气排入空气,造成空气污染
(4)设生成的铁的质量是x.
3CO+Fe2O3=2Fe+3CO2 质量差
160 112 48
x a
| 112 |
| x |
| 48 |
| a |
x=
| 7a |
| 3 |
答:生成的铁的质量是
| 7a |
| 3 |
故答为:(1)B→A→C→D→E
(2)检验并除去二氧化碳气体
(3)红色粉末逐渐变为黑色
(4)Ca(OH)2+CO2═CaCO3↓+H2O
(5)
| 7a |
| 3 |
(6)尾气排入空气,造成空气污染
点评:本题考查二氧化碳的性质,掌握仪器的连接方法,会利用多种方法根据化学方程式计算,了解一氧化碳的毒性和还原性.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目