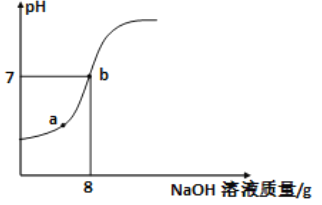
题目内容
如图是甲、乙两种固体(均不含结晶水)的溶解度曲线,由图可知:
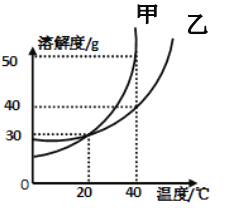
(1)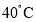 时的溶解度曲线甲____乙(填“>”“=”或“<”)。
时的溶解度曲线甲____乙(填“>”“=”或“<”)。
(2)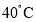 时甲的饱和溶液中溶质与溶剂的质量之比为____
时甲的饱和溶液中溶质与溶剂的质量之比为____
(3)将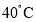 时乙的饱和溶液140g冷却到
时乙的饱和溶液140g冷却到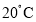 析出固体乙____g。
析出固体乙____g。
某小组同学通过资料发现,向不同浓度的碳酸钠和碳酸氢钠溶液中加入氯化钙溶液,会出现以下现象。继而对氯化钙与两种溶液的反应进行了探究。
Na2CO3 | NaHCO3 | |
现象一 | 产生沉淀 | 产生沉淀和气泡 |
现象二 | 产生沉淀 | 产生沉淀 |
现象三 | 产生沉淀 | 无沉淀 |
(查阅资料)
①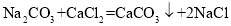
②Ca(HCO3)2易溶于水。
(进行实验)
实验一:70℃恒温水浴下,向10 mL不同浓度的Na2CO3和NaHCO3溶液中滴加10%的CaCl2溶液,现象如下表。
浓度 | Na2CO3 | NaHCO3 |
10% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,有较多气泡产生 |
5% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,30 s后有少量气泡产生 |
1% | 滴加1滴出现白色沉淀 | 滴加10滴出现浑浊 |
0.5% | 滴加1滴出现白色沉淀 | 滴加52滴出现浑浊 |
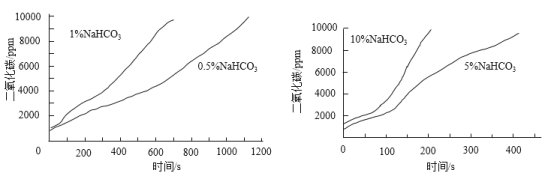
实验二:如图进行实验。70℃恒温水浴下,向10 mL不同浓度的NaHCO3溶液中滴加10%的CaCl2溶液,测得CO2浓度与时间的关系如下图。

(解释与结论)
(1)NaHCO3的俗称是________。
(2)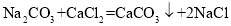 属于基本反应类型中的________反应。
属于基本反应类型中的________反应。
(3)补全NaHCO3与CaCl2反应的化学方程式: +________+________+H2O。
+________+________+H2O。
(4)实验二得出的结论是________。
(反思与评价)
(5)实验一中,向NaHCO3溶液中滴加CaCl2溶液时,有些只观察到浑浊、未观察到气泡,原因可能是________。
(6)小组同学发现的资料,现象三的NaHCO3溶液中无沉淀,其原因可能为_______。