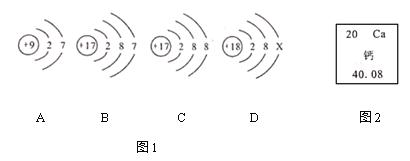
题目内容
【题目】科学家用通电的方法使水分解(图1),从而证明了水的组成。
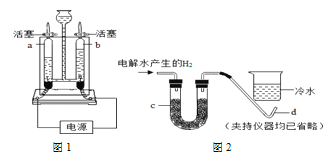
(1)把水注入水电解装置中,接通直流电源一段时间后,可以观察到的现象是____;反应的符号表达式为____。
(2)检验b管中产物的方法是____(填字母序号)。
A 用点燃的木条接近玻璃管尖嘴部分,慢慢打开活塞
B 用带火星的木条接近玻璃管尖嘴部分,慢慢打开活塞
C 用内壁沾有澄清石灰水的烧杯罩在尖嘴上方,慢慢打开活塞
(3)科学家还用点燃氢气,证明燃烧产物的方法证实了水的组成。如果将电解水产生的氢气直接缓缓地通过装有足量无水硫酸铜(无水硫酸铜遇水显蓝色)的仪器c,在导管口d处点燃,然后把盛有冷水的烧杯罩于如上图所示的位置。实验过程中可以观察到烧杯底部的现象是____。
(4)研究物质的化学反应,可以揭示物质的组成和物质之间转化的规律:
①根据化学反应前后____不变的原理,设计实验使物质参与一个化学反应,通过分析反应物或生成物的元素组成进一步确定该物质的组成元素。
②已知同温同压下,气体的体积比等于分子的个数比。根据反应生成氢气和氧气的体积比,可推求出:一个水分子由____构成。
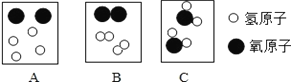
③如图是表示水分解时变化过程的微粒示意图,其出现的正确顺序是____(写字母表示)。
【答案】有气泡产生,a管的气体约为b管的2倍 H2O![]() H2+O2 B 有水雾生成 元素种类 2个氢原子和1个氧原子 CAB
H2+O2 B 有水雾生成 元素种类 2个氢原子和1个氧原子 CAB
【解析】
(1)水通电生成无色气体氢气和氧气,负极产生的氢气的体积约是正极产生的氧气体积的2倍,随气体的增加,管内水进入长颈漏斗;故答案为:有气泡产生,a管的气体约为b管的2倍;
反应的符号表达式为:H2O![]() H2+O2;
H2+O2;
(2)管内气体体积小于a管,说明管内气体为氧气,可用带火星的木条进行检验,故选B;
(3)实验过程为用无水硫酸铜检验并除去气体中少量的水,然后点燃气体,氢气燃烧生成的水遇温度较低烧杯,在杯底凝结成水雾;
(4)①根据化学反应前后元素的种类不变的原理,设计实验让物质参与一个化学反应,通过分析反应物或生成物的元素组成进一步确定该物质的组成元素。
②根据同温同压下体积比等于分子个数比,实验生成氢气和氧气的体积比为2:1故氢分子和氧分子的体积比为2:1,同时由于氢分子和氧分子都是双原子分子,所以可知水分子中氢原子和氧原子的个数比为2:1,水分子的化学式是H2O,一个水分子由2个氢原子和1个氧原子构成;
③由化学反应的实质可知:化学反应的过程就是参加反应的各物质的原子,重新组合生成其他物质的过程,所以,水分解生成氢气和氧气的过程就是水分子分解为氢原子和氧原子,每两个氢原子构成以一个氢分子,每两个氧原子构成一个氧分子,在图中化学变化过程中出现的顺序排列C→A→B;

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
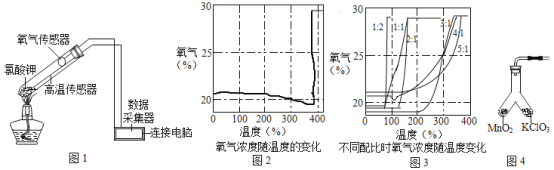
资料:①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
请回答问题:
(1)分析图2,氯酸钾分解温度__________(填“高于”、“等于”或“低于”)其熔点。
(2)分析图2,在氯酸钾分解前,传感器得到氧气浓度降低的可能原因是_________________。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_______________,当物质配比为1:2时,氯酸钾分解温度约为________℃。
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性。 | |
Ⅱ | 分别在“Y”形管两侧支管中加入少量二氧化锰和氯酸钾,塞紧橡皮塞。 | |
Ⅲ | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导管口。 | 加热左侧支管,可观察到_____, 加热右侧支管,可观察到_____。 |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤Ⅲ,木条很快复燃 |
请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到______________,加热右侧支管,可观察到_________________。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是_______________。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的符号表达式__________________。