题目内容
(8分)某课外小组研究“影响H2O2 生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
【提出猜想】催化剂和反应物浓度都会影响H2O2 生成O2 的快慢
【实验过程】实验装置图如下:
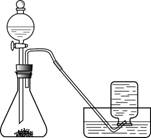
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录
|
实验编号 |
① |
② |
③ |
|
反应物 |
5%H2O2 100 mL |
5%H2O2 |
3%H2O2100 mL |
|
加入固体 |
0.5 g氯化钠固体 |
0.5 g二氧化锰 |
|
|
收集气体的时间 |
165 s |
46s |
80 s |
(1)H2O2溶液和二氧化锰制取氧气的化学方程式为 。
(2)实验②中加入H2O2的体积为 mL。
(3)实验③中加入的固体和用量为 。
【结论】该探究过程得出的结论是 。
【反思】H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰 和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为 。
【实验拓展】小红用收集的气体进行氧气的性质实验。
(1)检验氧气的方法是 。
(2)小红发现用该气体进行氧气的性质实验,现象都不明显。造成这种结果的原因是 。
|
【实验过程】(1)2H2O2 2H2O +O2↑ ……………………………1分
(2)100 ……………………………………………………1分
(3)0.5 g二氧化锰 ……………………………………………………1分
【结论】使用催化剂、增大反应物浓度可以加快H2O2 生成O2 的速度(或催化剂和反应物浓度都会影响H2O2 生成O2 的快慢)
说明:只答催化剂或浓度给1分 ………………………………………2分
【反思】5%H2O2 100 mL(不加其他催化剂) …………………………1分
【实验拓展】(1)将带火星的木条插入集气瓶中,木条复燃,证明集气瓶中为氧气。
……………………………………………………1分
(2)反应后首先排出的是锥形瓶中的空气,因此立即收集放出的气体中氧气纯度不高,导致铁丝无法在收集的气体中燃烧现象不明显。 ……………………………1分
【解析】
试题分析:【实验过程】
(1)H2O2溶液和二氧化锰制取氧气的化学方程式为2H2O2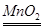 2H2O
+O2↑。
2H2O
+O2↑。
(2)为保证实验的科学性,实验②中加入H2O2的体积为应与实验①和③的液体体积相同,即100ml。
(3)为保证实验的科学性,实验③中加入的固体是二氧化锰,其用量应与实验①和②的固体质量相同,即0.5g
【结论】使用催化剂、增大反应物浓度可以加快H2O2 生成O2 的速度(或催化剂和反应物浓度都会影响H2O2 生成O2 的快慢)。
【反思】为了更好的证明二氧化锰 和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验,即只用5%H2O2 100 mL(不加其他催化剂),测定其分解反应的时间。
【实验拓展】(1)检验氧气的方法是将带火星的木条插入集气瓶中,木条复燃,证明集气瓶中为氧气。
(2)小红发现用该气体进行氧气的性质实验,现象都不明显。造成这种结果的原因是将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体所致,因为反应后首先排出的是锥形瓶中的空气,因此立即收集放出的气体中氧气纯度不高,导致实验现象不明显。
考点:实验设计与探究;氧气的性质;催化剂;化学方程式。
点评:为保证实验探究的科学性,控制一定的变量是有必要的;催化剂可以改变化学反应的速率,但其本身的质量和化学性质都不变。

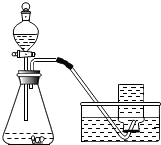 某课外小组研究“影响H2O2 生成O2快慢的因素”的课题.通过查阅资料,他们提出如下猜想.
某课外小组研究“影响H2O2 生成O2快慢的因素”的课题.通过查阅资料,他们提出如下猜想.[提出猜想]催化剂和反应物浓度都会影响H2O2 生成O2的快慢
[实验过程]实验装置图如图所示:
实验操作:检查装置气密性良好.将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体.
实验记录:
| 实验编号 | ① | ② | ③ |
| 反应物 | 5%H2O2100mL | 5%H2O2 | 3%H2O2100mL |
| 加入固体 | 0.5g氯化钠固体 | 0.5g二氧化锰 | |
| 收集气体的时间 | 165s | 46s | 80s |
(2)实验②中加入H2O2的体积为
(3)实验③中加入的固体和用量为
[结论]该探究过程得出的结论是
[反思]H2O2在常温下分解缓慢,加入MnO2后反应明显加快.小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验.该实验选用的药品和用量为
[实验拓展]小红用收集的气体进行氧气的性质实验.
(1)检验氧气的方法是
(2)小红发现用该气体进行氧气的性质实验,现象都不明显.造成这种结果的原因是
(8分)某课外小组研究“影响H2O2生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
【提出猜想】催化剂和反应物浓度都会影响H2O2生成O2 的快慢
【实验过程】实验装置图如下:
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录
| 实验编号 | ① | ② | ③ |
| 反应物 | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2100 mL |
| 加入固体 | 0.5 g氯化钠固体 | 0.5 g二氧化锰 | |
| 收集气体的时间 | 165 s | 46s | 80 s |
(2)实验②中加入H2O2的体积为 mL。
(3)实验③中加入的固体和用量为 。
【结论】该探究过程得出的结论是 。
【反思】H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为 。
【实验拓展】小红用收集的气体进行氧气的性质实验。
(1)检验氧气的方法是 。
(2)小红发现用该气体进行氧气的性质实验,现象都不明显。造成这种结果的原因是 。
提出猜想:催化剂和反应物浓度都会影响H2O2生成O2的反应速率
实验过程:实验装置如图:
实验操作:检查装置的气密性良好.将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体.
实验记录:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 反应物 | 5%H2O250mL | 5%H2O2______ | 3%H2O250mL |
| 加入固体 | 0.5gCuO | 0.5gMnO2 | 0.5gMnO2 |
| 收集等体积O2所需时间 | 105s | 45s | 78s |
②充分反应后,将实验Ⅱ中剩余物质里的MnO2提取的方法是______;
结论:该探究过程得出的结论是______;
反思:H2O2在常温加入MnO2后反应速率加快.小敏提出,为了更好的证明二氧化锰是否对H2O2 生成O2的反应速率有影响,还应该增加一组对比实验.该实验选用的药品和用量为______;
实验拓展:小敏用收集的气体进行氧气的性质实验.
①铁丝在氧气中燃烧,其反应的化学方程式为______
[提出猜想]催化剂和反应物浓度都会影响H2O2 生成O2的快慢
[实验过程]实验装置图如图所示:
实验操作:检查装置气密性良好.将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体.
实验记录:
| 实验编号 | ① | ② | ③ |
| 反应物 | 5%H2O2100mL | 5%H2O2 | 3%H2O2100mL |
| 加入固体 | 0.5g氯化钠固体 | 0.5g二氧化锰 | |
| 收集气体的时间 | 165s | 46s | 80s |
 (2012?长宁区二模)某课外小组研究“影响H2O2生成O2反应速率的因素”的课题.通过查阅资料,他们提出如下猜想.
(2012?长宁区二模)某课外小组研究“影响H2O2生成O2反应速率的因素”的课题.通过查阅资料,他们提出如下猜想.