题目内容
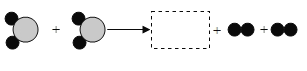
【题目】铭铭在课外科学探究实验中发现, 金属钠可以在二氧化碳中燃烧, 化学方程式为: 3CO2+4Na![]() C+2X. 请回答并利用化学方程式计算以下问题:
C+2X. 请回答并利用化学方程式计算以下问题:
(1)化学方程式中x的化学式为 。
(2)计算11.5g含杂质为20%的金属钠, 理论上可消耗多少克二氧化碳?
【答案】(1)Na2CO3
(2)13.2g
【解析】
(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,根据化学方程式:3CO2+4Na![]() C+2X,可以知道:反应前有3个C原子,6个O原子,4个Na原子,反应后除2X外有1个C原子,可推断出2X由4个Na原子,2个C原子,6个O原子组成,则1个X组成为:2个Na原子,1个C原子,3个O原子,由此可推断出X的化学式为:Na2CO3,故填:Na2CO3。
C+2X,可以知道:反应前有3个C原子,6个O原子,4个Na原子,反应后除2X外有1个C原子,可推断出2X由4个Na原子,2个C原子,6个O原子组成,则1个X组成为:2个Na原子,1个C原子,3个O原子,由此可推断出X的化学式为:Na2CO3,故填:Na2CO3。
(2)解:设需要消耗二氧化碳的质量为x
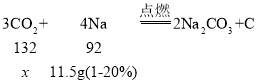
![]()
![]()
答:需要消耗二氧化碳的质量为13.2g。

【题目】根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)上表中的三种物质在20℃时,___________的溶解度最大;
(2)将40 ℃时NH4Cl和NaCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:NaCl_____NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3 溶液中混有少量的NaCl,要得到KNO3 晶体的方法是_______。
(4)A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。
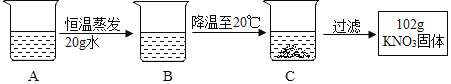
对以上过程的分析,正确的是__________(选填编号)。
① A到B的过程中,溶质质量没有改变
② B中溶质与溶剂的质量比为 169:100
③ 开始析出KNO3固体的温度在60℃至80℃之间
④ A溶液的质量等于222 g