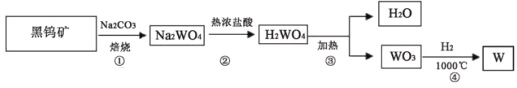
题目内容
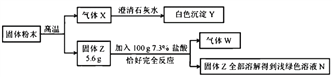
【题目】某固体粉末可能含有碳酸钙、硫酸钠、氯化钡、硫酸铜中的一种或几种。为确定该固体粉末的成分,进行如下实验:
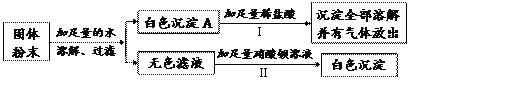
回答下列问题:
(1)反应I的化学方程式_________________________。
(2)白色沉淀C是___________(填化学式)。
(3)原固体粉末一定含______________(填化学式)。
【答案】 CaCO3+2HCl==CaCl2+H2O+CO2↑ BaSO4 、CaCO3 Na2SO4
【解析】某固体粉末可能含有碳酸钙、硫酸钠、氯化钡、硫酸铜中的一种或几种。加足量的水得到白色沉淀和无色溶液。固体粉末中一定没有硫酸铜,铜离子呈蓝色。白色沉淀中加入足量稀盐酸沉淀全部溶解,并有气体放出,白色沉淀一定是碳酸钙,碳酸钙与稀盐酸反应生成二氧化碳气体。无色溶液中加入足量的硝酸钡溶液生成白色沉淀,原溶液中一定有硫酸钠,固体粉末中一定没有氯化钡,氯化钡与硫酸钠反应生成不溶于酸的白色沉淀硫酸钡。(1)反应I的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。(2)白色沉淀C是BaSO4 。(3)原固体粉末一定含CaCO3 和Na2SO4。
点睛∶这是一道推断题,铜离子呈蓝色。硫酸钡是一种不溶于酸的白色沉淀。碳酸钙与稀盐酸反应生成二氧化碳气体。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目