题目内容
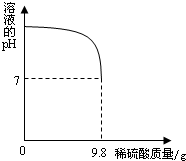 某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算:
某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算:
(1)用40%的浓硫酸(密度为1.30g/cm3)l0mL配制2%的稀硫酸,需加水(密度为1.0g/cm3)多少毫升?
(2)向盛有20g废水的锥形瓶中逐滴滴加2%的稀硫酸,至恰好完全反应.将实验所得数据绘制成右图所示图象.求废水中氢氧化钾的质量分数?
解:(1)设需加水的质量为x.
1.30g/ml×10ml×40%=(1.30g/ml×10ml+x)×2%
x=247g
 =247ml 答:需加水247ml.
=247ml 答:需加水247ml.
(2)稀硫酸中所含H2SO4的质量为:9.8g×2%=0.196g
设:氢氧化钾的质量为y
H2SO4+2KOH=K2SO4+2H2O
98 112
0.196g y
 ,y=0.224g
,y=0.224g
废水中氢氧化钾的质量分数为: ×100%=1.12%
×100%=1.12%
答:废水中氢氧化钾的质量分数为1.12%.
分析:(1)根据稀释前后溶液中溶质的质量不变列出等式.
(2)根据硫酸的质量求出氢氧化钾的质量,再根据 ×100%求出废水中氢氧化钾的质量分数.
×100%求出废水中氢氧化钾的质量分数.
点评:稀释溶液时,浓溶液的质量+水的质量=稀溶液的质量,但浓溶液的体积+水的体积≠稀溶液的体积,因为分子之间有间隔.
1.30g/ml×10ml×40%=(1.30g/ml×10ml+x)×2%
x=247g
 =247ml 答:需加水247ml.
=247ml 答:需加水247ml.(2)稀硫酸中所含H2SO4的质量为:9.8g×2%=0.196g
设:氢氧化钾的质量为y
H2SO4+2KOH=K2SO4+2H2O
98 112
0.196g y
 ,y=0.224g
,y=0.224g废水中氢氧化钾的质量分数为:
 ×100%=1.12%
×100%=1.12% 答:废水中氢氧化钾的质量分数为1.12%.
分析:(1)根据稀释前后溶液中溶质的质量不变列出等式.
(2)根据硫酸的质量求出氢氧化钾的质量,再根据
 ×100%求出废水中氢氧化钾的质量分数.
×100%求出废水中氢氧化钾的质量分数.点评:稀释溶液时,浓溶液的质量+水的质量=稀溶液的质量,但浓溶液的体积+水的体积≠稀溶液的体积,因为分子之间有间隔.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
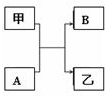 (1)在分开盛放的A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3-、Cl-、CO32-七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是________.
(1)在分开盛放的A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3-、Cl-、CO32-七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是________.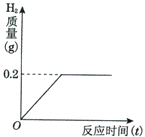 将一定质量的金属锌投入93.7克的稀硫酸中恰好完全反应,放出气体的质量与反应时间(t)的关系如图所示.请你据此分析计算:
将一定质量的金属锌投入93.7克的稀硫酸中恰好完全反应,放出气体的质量与反应时间(t)的关系如图所示.请你据此分析计算: