题目内容
(2013?扬州)科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.

(1)步骤1的化学方程式为
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量
(3)上述设想的优点有
a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为
a.无色酚酞溶液 b.紫色石蕊溶液 c.PH试纸
(5)请列举CO2的另两种用途

(1)步骤1的化学方程式为
CaO+CO2
CaCO3
| ||
CaO+CO2
CaCO3
.
| ||
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量
盐酸
盐酸
溶液,若观察到试管内有气泡产生
有气泡产生
.则分解不完全.(3)上述设想的优点有
ab
ab
(填字母序号).a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为
1:1
1:1
,若要检验1%甲酸水溶液是否显酸性,能选用的有bc
bc
(填字母序号).a.无色酚酞溶液 b.紫色石蕊溶液 c.PH试纸
(5)请列举CO2的另两种用途
灭火
灭火
,制碳酸饮料
制碳酸饮料
.分析:(1)根据图示信息可知二氧化碳和氧化钙在400℃生成碳酸钙,据此书写方程式;
(2)根据碳酸钙遇酸产生二氧化碳的性质分析回答;
(3)根据反应的原料及反应的条件分析选择;
(4)根据方程式的书写及反应前后原子的个数不变分析;根据酸性物质与指示剂的关系选择;
(5)根据二氧化碳的性质分析其用途.
(2)根据碳酸钙遇酸产生二氧化碳的性质分析回答;
(3)根据反应的原料及反应的条件分析选择;
(4)根据方程式的书写及反应前后原子的个数不变分析;根据酸性物质与指示剂的关系选择;
(5)根据二氧化碳的性质分析其用途.
解答:解:(1)根据图示信息可知二氧化碳和氧化钙在400℃生成碳酸钙,方程式是:CaO+CO2
CaCO3;
(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;
(3)观察流程图可以看出反应原料是氧化钙和二氧化碳,反应条件是利用太阳能,因此有原料易得且可循环利用,充分利用太阳能的优点,但会受到地域、天气的限制的缺点,故可全地域全天候使用是错误的;
(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7,因此选择bc;
(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火;
二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等.
故答案为:(1)CaO+CO2
CaCO3;(2)盐酸;有气泡产生;(3)ab;(4)1:1;bc;(5)灭火;制碳酸饮料.
| ||
(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;
(3)观察流程图可以看出反应原料是氧化钙和二氧化碳,反应条件是利用太阳能,因此有原料易得且可循环利用,充分利用太阳能的优点,但会受到地域、天气的限制的缺点,故可全地域全天候使用是错误的;
(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7,因此选择bc;
(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火;
二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等.
故答案为:(1)CaO+CO2
| ||
点评:本题属于信息题,考查了有关二氧化碳、碳酸钙等的性质和用途,难度不大,依据已有的知识结合题目的信息分析即可.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 (2013?扬州)甲、乙两物质发生反应的微观示意图如下,下列说法正确的是( )
(2013?扬州)甲、乙两物质发生反应的微观示意图如下,下列说法正确的是( )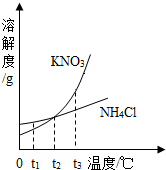 (2013?扬州)如图是KNO3和NH4Cl的溶解度曲线.下列说法正确的是( )
(2013?扬州)如图是KNO3和NH4Cl的溶解度曲线.下列说法正确的是( )