题目内容
下表是3种物质在不同温度时的溶解度,根据表格信息答题.| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
| Ca(OH)2 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 | |
(2)在60℃时,S(NaCl) S(KNO3)(填写“>”、“<”或“=”).
(3)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g;(保留小数点后一位).
(4)某KNO3晶体中有少量NaCl杂质,要得到纯净KNO3的方法是:先 ,然后 ,再过滤,洗涤、干燥后得到KNO3晶体.
(5)在盛有20℃时的Ca(OH)2饱和溶液中,加入少量生石灰并待冷却至20℃.与加入前相比,溶液中溶质的质量将 (填:增大、减小或不变),溶液中溶质的质量分数将 (填:增大、减小或不变).
【答案】分析:(1)根据溶解度与温度的关系考虑;(2)由图表数据考虑;(3)根据饱和溶液中溶质的计算方法考虑;(4)固体物质从溶液中结晶析出的方法考虑;(5)根据生石灰与水反应,夺取了水分,使溶质析出考虑.
解答:解:(1)饱和溶液随温度升高有固体析出,说明升高温度后该物质的溶解度减小,才能析出晶体,由图表中数据可知氢氧化钙的溶解度随温度升高而减小;
(2)由图表数据可知S(NaCl)<S(KNO3);
(3)设NaCl饱和溶液100g中含有氯化钠质量为X则: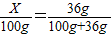 解得X=26.5g;
解得X=26.5g;
(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于KNO3晶体中有少量NaCl杂质,硝酸钾的溶解度随温度变化比较大,所以先用热水溶解,再降温结晶,硝酸钾会结晶析出,再过滤,洗涤、干燥后得到KNO3晶体;
(5)在盛有20℃时的Ca(OH)2饱和溶液中,加入少量生石灰,生石灰与水反应生成氢氧化钙,使饱和氢氧化钙溶液中溶剂减少,有些溶质溶不了就会结晶析出,所以溶质减少,由于析出晶体了,溶液仍然是饱和溶液,饱和溶液的溶质质量分数大小与溶解度有关,因为温度没变,溶解度没变,所以溶质质量分数不变.
故答案为:(1)Ca(OH)2;(2)<;(3)26.5;(4)(用沸水)用热水溶解;(用冰水)降温结晶;(5)减小;不变.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液溶质质量分数的计算与溶解度有关,固体物质从溶液中结晶析出的方法.
解答:解:(1)饱和溶液随温度升高有固体析出,说明升高温度后该物质的溶解度减小,才能析出晶体,由图表中数据可知氢氧化钙的溶解度随温度升高而减小;
(2)由图表数据可知S(NaCl)<S(KNO3);
(3)设NaCl饱和溶液100g中含有氯化钠质量为X则:
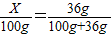 解得X=26.5g;
解得X=26.5g;(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于KNO3晶体中有少量NaCl杂质,硝酸钾的溶解度随温度变化比较大,所以先用热水溶解,再降温结晶,硝酸钾会结晶析出,再过滤,洗涤、干燥后得到KNO3晶体;
(5)在盛有20℃时的Ca(OH)2饱和溶液中,加入少量生石灰,生石灰与水反应生成氢氧化钙,使饱和氢氧化钙溶液中溶剂减少,有些溶质溶不了就会结晶析出,所以溶质减少,由于析出晶体了,溶液仍然是饱和溶液,饱和溶液的溶质质量分数大小与溶解度有关,因为温度没变,溶解度没变,所以溶质质量分数不变.
故答案为:(1)Ca(OH)2;(2)<;(3)26.5;(4)(用沸水)用热水溶解;(用冰水)降温结晶;(5)减小;不变.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液溶质质量分数的计算与溶解度有关,固体物质从溶液中结晶析出的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下表是3种物质在不同温度时的溶解度,根据表格信息答题
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式)
(2)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g(保留小数点后一位)
(3)某KNO3晶体中有少量NaCl杂质,要得到纯净KNO3的方法是:先加热溶解,然后 ,过滤、洗涤、干燥后得到KNO3晶体
(4)现有60℃KNO3饱和溶液210g,若加热蒸发掉10g水后恢复至60℃,析出硝酸钾晶体的质量为 g.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
| Ca(OH)2 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
(2)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为
(3)某KNO3晶体中有少量NaCl杂质,要得到纯净KNO3的方法是:先加热溶解,然后
(4)现有60℃KNO3饱和溶液210g,若加热蒸发掉10g水后恢复至60℃,析出硝酸钾晶体的质量为
下表是3种物质在不同温度时的溶解度,根据表格信息答题.
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式).
(2)在40℃时,S(NaCl) S(KNO3)(填写“>”、“<”或“=”).
(3)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g(保留小数点后一位).
(4)某KNO3晶体中有少量NaCl杂质,要得到纯净KNO3的方法是:先加热溶解,然后
,过滤、洗涤、干燥后得到KNO3晶体.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
| Ca(OH)2 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 | |
(2)在40℃时,S(NaCl)
(3)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为
(4)某KNO3晶体中有少量NaCl杂质,要得到纯净KNO3的方法是:先加热溶解,然后
