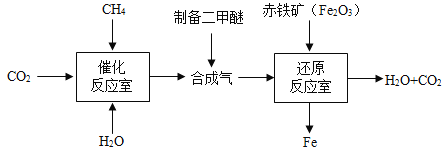
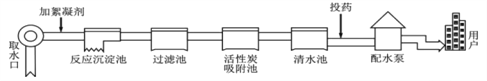
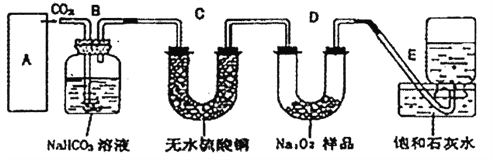
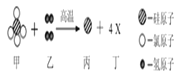
��Ŀ����
����Ŀ��Ϊ����![]() ���Ȼ��Ʊ�����Һ�������Բⶨ
���Ȼ��Ʊ�����Һ�������Բⶨ![]() ʱ�Ȼ��Ƶ��ܽ�ȡ�����������ʵ�������
ʱ�Ȼ��Ƶ��ܽ�ȡ�����������ʵ�������
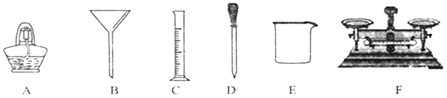
![]() ��ȡ
��ȡ![]() �Ȼ��Ʒ�ĩ��
�Ȼ��Ʒ�ĩ��
![]() ��ȡ
��ȡ![]() ��ˮ
��ˮ![]() �ܶȿ���Ϊ
�ܶȿ���Ϊ![]() �����ձ��С�
�����ձ��С�
![]() ���Ȼ�������ˮ�У��ò����������������ܽ⡣
���Ȼ�������ˮ�У��ò����������������ܽ⡣
![]() ���˳�δ�ܽ���Ȼ��ƣ����Ƶ�ʣ���Ȼ�������Ϊ
���˳�δ�ܽ���Ȼ��ƣ����Ƶ�ʣ���Ȼ�������Ϊ![]() ��
��
![]() ����
����![]() ��
��![]() ��
��![]() �в����õ���������______��
�в����õ���������______��![]() д��ĸ���
д��ĸ���![]()
![]() ����
����![]() ���ò����������Ŀ����______��
���ò����������Ŀ����______��
![]() ��ʵ�����Ȼ��Ƶ��ܽ��Ϊ______��
��ʵ�����Ȼ��Ƶ��ܽ��Ϊ______��
![]() ����
����![]() �У�����ȡˮʱ���Ӷ����������������Ƶı�����Һ���Ȼ��Ƶ���������______
�У�����ȡˮʱ���Ӷ����������������Ƶı�����Һ���Ȼ��Ƶ���������______![]() ����ƫ��������ƫС��������������
����ƫ��������ƫС��������������![]()
![]() �����˽��齫
�����˽��齫![]() �Ȼ���Ͷ��70g��ˮ��30g����ɵı�ˮ������н���������ǡ����ʧʱ�ٽ��в���
�Ȼ���Ͷ��70g��ˮ��30g����ɵı�ˮ������н���������ǡ����ʧʱ�ٽ��в���![]() ��
��
С����Ϊ�ý��鲻����������������______��
���𰸡� A �ӿ��Ȼ��Ƶ��ܽ� ![]() ���� �Ȼ��ƿ��Խ���ˮ�����̵�
���� �Ȼ��ƿ��Խ���ˮ�����̵�
��������(1)��ȡ������������ƽ��ҩ�ס���ȡҺ������Ͳ�ͽ�ͷ�ι����ܽ���Ҫ���������ձ��Ͳ��������������õ��������Ǿƾ��ƣ�(2)�ܽ����ò����������Ŀ���Ǽ����ܽ⣻(3) �ܽ����һ���¶��£�100g�ܼ���ﵽ����ʱ�����ܽ�����ʵ���������ʵ�����Ȼ��Ƶ��ܽ��Ϊ40g-4.3g=35.7g;(4) ![]() ��Ӱ���ܽ�ȵ����������¶������ʺ��ܼ������ʣ������ࣩ��������У�����ȡˮʱ���Ӷ�����������ȡˮ�����ƫС���������Ƶı�����Һ���Ȼ��Ƶ������������䣻(5)��ˮ�������¶�Ϊ0�棻�γɻ������������ʵ��۵㽵�ͣ��е����ߡ� �ʼ����Ȼ��ƺ�ˮ�����̵� ���ͣ�������Һ���¶ȿ��ܵ���
��Ӱ���ܽ�ȵ����������¶������ʺ��ܼ������ʣ������ࣩ��������У�����ȡˮʱ���Ӷ�����������ȡˮ�����ƫС���������Ƶı�����Һ���Ȼ��Ƶ������������䣻(5)��ˮ�������¶�Ϊ0�棻�γɻ������������ʵ��۵㽵�ͣ��е����ߡ� �ʼ����Ȼ��ƺ�ˮ�����̵� ���ͣ�������Һ���¶ȿ��ܵ���![]()