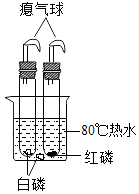
题目内容
【题目】已知氯化钠和硝酸钾的溶解度如表:
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,氯化钠饱和溶液的溶质质量分数是%.
(2)请在如图中画出KNO3的溶解度曲线:图中两溶解度曲线交点的意义是 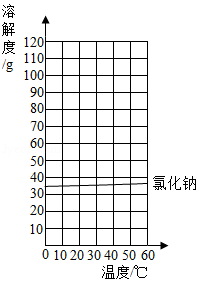
(3)KNO3是化学肥料中的肥料,从热的KNO3浓溶液中析出晶体的方法是 .
【答案】
(1)26.5
(2)在该温度下,氯化钠和硝酸钾的溶解度相等
(3)复合;降温结晶或冷却
【解析】解:(1)20℃时,氯化钠饱和溶液的溶质质量分数= ![]() ≈26.5%;故答案为:26.5;(2)图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;故答案为:在该温度下,氯化钠和硝酸钾的溶解度相等;画图如下:
≈26.5%;故答案为:26.5;(2)图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;故答案为:在该温度下,氯化钠和硝酸钾的溶解度相等;画图如下:  ;(3)KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却;故答案为:复合;降温结晶或冷却; 根据题目信息和表格可知:20℃时,氯化钠饱和溶液的溶质质量分数=
;(3)KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却;故答案为:复合;降温结晶或冷却; 根据题目信息和表格可知:20℃时,氯化钠饱和溶液的溶质质量分数= ![]() ≈26.5%;图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却.
≈26.5%;图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却.

 阅读快车系列答案
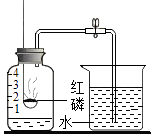
阅读快车系列答案【题目】某化学兴趣小组在学习盐的知识时,发现碳酸钠和碳酸钙的组成很相似,他们想知道碳酸钠与稀盐酸反应是否也生成二氧化碳,于是做了如图所示实验. 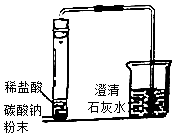
(1)当观察到试管中有气泡产生,烧杯中出现现象时,由此可以得出结论:碳酸钠与稀盐酸反应也生成二氧化碳,烧杯中发生反应的化学方程式为 .
(2)实验结束后,同学们将试管中的物质倒入烧杯中,发现烧杯中的白色沉淀明显增加,于是他们将烧杯内的物质进行过滤,对所得滤液中的溶质进行了探究. 【问题】滤液中溶质的成分有哪些?
【猜想】小刚的猜想:滤液中的溶质是氯化钠、氢氧化钠
小钰的猜想:滤液中的溶质是氯化钠、氢氧化钠、碳酸钠
小伟的猜想:滤液中的溶质是 .
(3)【实验】
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,通入二氧化碳气体 | 小伟的猜想不成立 | |
另取少量滤液于试管中,加入适量的 | 有白色沉淀生成 | 小刚的猜想不成立 |
(4)【拓展】小钰想进一步验证溶质中的氢氧化钠,如果她重新取少量滤液于试管中,实验过程中需选择的试剂是(填序号). ①氯化钙溶液②氢氧化钙溶液③稀盐酸④酚酞溶液.