题目内容
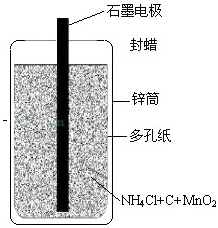
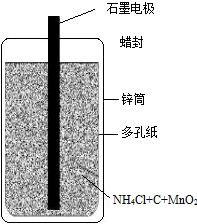
 26、日常用的干电池构造、组成如图1.某校化学活动小组进行的研究课题是《回收电池,变废为宝,保护环境》
26、日常用的干电池构造、组成如图1.某校化学活动小组进行的研究课题是《回收电池,变废为宝,保护环境》| 实验操作 | 实验现象 | 实验结论 |
| ①取样于试管中,滴入 氢氧化钠 溶液微热; |
①有 气体 产生; |
回收的物质中有NH4+ |
| ②将湿润的 红 色石蕊试纸放在试管口. |
②试纸变 蓝 . |
生成的气体是氨气 |
封蜡
(写一种);用碳棒做电极主要利用了石墨的导电
性.(2)如表回收得到的NH4Cl是一种重要的
氮
肥,设计实验证明其有NH4+写出操作①中的化学反应方程式NH4Cl+NaOH═NaCl+H2O+NH3↑
.(3)用锌皮与废弃的稀硫酸反应制得ZnSO4晶体和一种气体,写出其化学方程式:
Zn+H2SO4=ZnSO4+H2↑
.分析:根据含铵根离子的盐和可溶性碱反应生成使湿润的红色石蕊试纸变蓝的化学现象进行分析判断;
(1)根据有机物的定义分析判断,石墨具有优良的导电性;
(2)根据物质中是否含有N、P、K元素判断所需的化肥类别,写出氯化铵和氢氧化钠反应的化学方程式;
(3)写出锌和稀硫酸反应的化学方程式.
(1)根据有机物的定义分析判断,石墨具有优良的导电性;
(2)根据物质中是否含有N、P、K元素判断所需的化肥类别,写出氯化铵和氢氧化钠反应的化学方程式;
(3)写出锌和稀硫酸反应的化学方程式.
解答:解:
(1)图1中所标物质中含有有机物的是:封蜡;用碳棒做电极主要利用了石墨的导电性;
(2)如表回收得到的NH4Cl是一种重要的氮肥,操作①中的化学反应方程式:NH4Cl+NaOH═NaCl+H2O+NH3↑;
(3)锌皮与废弃的稀硫酸反应制得ZnSO4晶体和一种气体,写出其化学方程式:Zn+H2SO4=ZnSO4+H2↑.
故答案为:(1)封蜡;导电性;
(2)NH4Cl+NaOH═NaCl+H2O+NH3↑;
(3)Zn+H2SO4=ZnSO4+H2↑.
| 实验操作 | 实验现象 | 实验结论 |
| ①氢氧化钠 | ①气体 | |
| ②红 | ②蓝 | 生成的气体是氨气 |
(2)如表回收得到的NH4Cl是一种重要的氮肥,操作①中的化学反应方程式:NH4Cl+NaOH═NaCl+H2O+NH3↑;
(3)锌皮与废弃的稀硫酸反应制得ZnSO4晶体和一种气体,写出其化学方程式:Zn+H2SO4=ZnSO4+H2↑.
故答案为:(1)封蜡;导电性;
(2)NH4Cl+NaOH═NaCl+H2O+NH3↑;
(3)Zn+H2SO4=ZnSO4+H2↑.
点评:本题以生活中的干电池为依托,对物质的分类及物质的反应化学方程式进行考查,考查了学生运用化学知识解决具体问题的能力.

练习册系列答案
相关题目
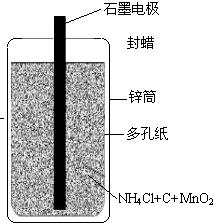 22、日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是
22、日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是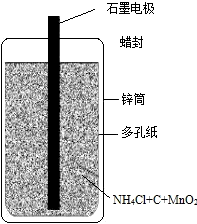 日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是《回收电池,变废为宝,保护环境--用锌皮制ZnSO4晶体》,请你和他们一道完成下列报告:
日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是《回收电池,变废为宝,保护环境--用锌皮制ZnSO4晶体》,请你和他们一道完成下列报告: