题目内容
【题目】【2016年广东省】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2。

(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
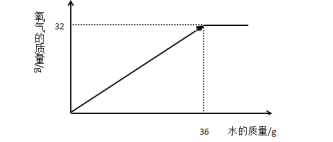
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在右图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 | 相对分子质量 | 纯度 | 价格(元/kg) |
Na2O2 | 78 | 98% | 25 |
CaO2 | 72 | 94% | 24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?
【答案】(1)96% (2)如图所示(3)过氧化钙可制得更多的氧气
【解析】试题分析:利用化学方程式,根据反应的质量比即可计算出个物质的质量。
(1)解:设过氧化钙的质量为X;水的质量为Y
2CaO2+2H2O=2Ca(OH)2+O2 ![]()
144 36 32
X Y 32g
即X=32*144g/32 X=144g Y =36g
过氧化钙的质量分数=144g/150g*100%=96%
(2)
(3)解:设过氧化钠产生的氧气质量为X
3000元购买过氧化钠质量=3000/25*98%=117.6kg
2Na2O2+2H2O=4NaOH+O2 ![]()
156 32
117.6kg X
即X=32*117.6kg/32 X=24.1kg
24.1kg<26.1kg 所以过氧化钙可制得更多的氧气

练习册系列答案
相关题目