题目内容
【题目】将39.5g含高锰酸钾质量分数为80%的固体加热(杂质不发生化学反应也不含钾元素)加热一段时间后,冷却,测得剩余固体中钾元素的质量分数为20.58%,则生成二氧化锰的质量约为
A. 2.9 g B. 4.35 g C. 8.7 g D. 10.9 g
【答案】B
【解析】
试题分析:根据质量守恒定律,化学反应前后元素的种类不变,元素的质量不变,可知钾元素反应前后其质量没有发生改变;可先求出反应前高锰酸钾中钾元素的质量,从而求出冷却后剩余固体的总质量;然后根据质量守恒定律,求出加热一段时间后生成的氧气的质量;再根据氧气的质量,利用化学方程式便可求出生成二氧化锰的质量。
解:39.5克含高锰酸钾质量分数为80%的固体中钾元素的质量为:39.5g×80%×![]() ×100%=7.8g;
×100%=7.8g;
加热一段时间后,冷却,剩余固体的质量为:7.8g÷20.58%=37.9g;
根据质量守恒定律,生成氧气的质量为:39.5g-37.9g=1.6g;
设:生成二氧化锰的质量为X
2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
87 32
X 1.6g
87:32 =x:1.6 g,解得X═4.35 g
答:生成二氧化锰的质量为4.35克。故选B

 名校课堂系列答案
名校课堂系列答案【题目】一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,设计了两种方案。
方案一:取少量该黑色粉末做右图所示实验:
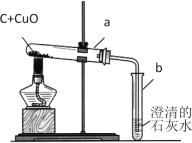
(1)若试管b中澄清的石灰水变浑浊,则试管b中一定发生反应的化学方程式为__________。
(2)若试管a中的黑色粉末变红色,则说明黑色粉末是_____;
若黑色粉末不变色,则说明黑色粉末是_______。
方案二:取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察。下表是实验中可能出现的现象与对应结论,请你填写下表中空白处的相关内容:
(提示:木炭不与硫酸反应,氧化铜能与硫酸反应得到蓝色溶液)
现象 | 结论 |
① ________ | 含CuO、C |
溶液颜色无明显变化,有黑色不溶物 | 只含②_______ |
以上两种方案,哪种较好,并说出理由_______。