题目内容
【题目】实验小组的同学为测定某氯酸钾样品(含有氯化钾)中氯酸钾的纯度,取1.0 g二氧化锰与一定质量的样品混合均匀后放入大试管中进行加热。测量所得数据如表所示:
时间/ min | 0 | 3 | 4 | 5 | 6 | 7 |
试管中剩余固体的质量/g | 16.0 | 15.6 | 12.3 | 11.7 | 11.2 | 11.2 |
试计算:
(1)反应共产生氧气的质量为__________g;
(2)样品中氯酸钾的纯度__________。(要求写出计算过程,结果精确到0.1% )
(3)在实验进行到第5分钟时剩余固体的成分是_______(写化学式)。
【答案】4.8 81.7%(详见解析) KCl、KClO3、MnO2
【解析】
(1)根据质量守恒定律可知,反应共产生氧气的质量=16.0g-11.2g=4.8g;
(2)设样品中氯酸钾的质量为x
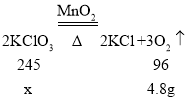
![]() x=12.25g;
x=12.25g;
则样品中氯酸钾的纯度=![]()
答:样品中氯酸钾的纯度约为81.7%。
(3)反应在第6分钟时彻底反应完全,故实验进行到第5分钟时反应物还没有完全反应,故剩余固体中含有KCl、KClO3,二氧化锰是该反应的催化剂,其化学性质和质量在反应前后不变,则剩余固体中还含有二氧化锰。在实验进行到第5分钟时剩余固体的成分是KCl、KClO3、MnO2。

练习册系列答案
相关题目