题目内容
工业上是用氨气还原氧化铜制取铜的.某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验.查阅到的信息:
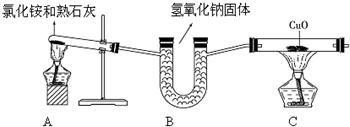
(1)氨气是一种无色、有刺激性气味的气体,不易燃,密度比空气小,极易溶于水,氨水显碱性.实验室常用加热氯化铵晶体和熟石灰固体混合物的方法制取氨气,同时生成氯化钙和水.
(2)氨气还原氧化铜制取铜的反应原理:2NH3+3CuO
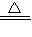 3Cu+N2+3H2O 2NH3+3CuO
3Cu+N2+3H2O 2NH3+3CuO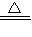 3Cu+N2+3H2O
3Cu+N2+3H2O某小组设计了如下实验装置并进行实验
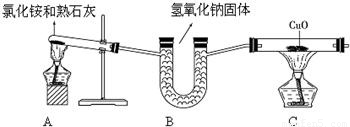
试回答:
(1)写出装置A中试管内发生反应的化学方程式: ;
(2)装置B所起的作用是 ;
(3)装置C中可观察到的实验现象是 ;
(4)你认为该小组的实验设计还存在着哪些不足? .
【答案】分析:(1)根据反应物和反应规律书写化学方程式,铵盐和碱反应生成氨气;
(2)根据A的生成物和烧碱的吸水性分析;
(3)从生成物的性质回答反应现象,氧化铜的黑色粉末,生成的铜是红色的;
(4)氨气是一种有刺激性气味的气体,不完全参加反应,能污染空气.
解答:解:(1)氯化铵和熟石灰发生反应的化学方程式为:Ca(OH)2+2NH4Cl═CaCl2+2H2O+2NH3↑
(2)A装置生成的氨气中含有水蒸气,因此装置B所起的作用是 干燥氨气;
(3)反应后生成铜,故装置C中可观察到的实验现象是 黑色粉末变成红色;
(4)氨气的反应中没有全部反应,有刺激性气味,不能排放到空气中,因此要进行尾气处理.
故答案为:(1)氯化铵和熟石灰发生反应的化学方程式为:Ca(OH)2+2NH4Cl═CaCl2+2H2O+2NH3↑
(2)干燥氨气(3)黑色粉末变成红色(4)尾气没有处理
点评:根据铵盐和碱的反应规律,结合实验装置的特点及生成物的性质,通过分析判断来解答此类问题.
(2)根据A的生成物和烧碱的吸水性分析;
(3)从生成物的性质回答反应现象,氧化铜的黑色粉末,生成的铜是红色的;
(4)氨气是一种有刺激性气味的气体,不完全参加反应,能污染空气.
解答:解:(1)氯化铵和熟石灰发生反应的化学方程式为:Ca(OH)2+2NH4Cl═CaCl2+2H2O+2NH3↑
(2)A装置生成的氨气中含有水蒸气,因此装置B所起的作用是 干燥氨气;
(3)反应后生成铜,故装置C中可观察到的实验现象是 黑色粉末变成红色;
(4)氨气的反应中没有全部反应,有刺激性气味,不能排放到空气中,因此要进行尾气处理.
故答案为:(1)氯化铵和熟石灰发生反应的化学方程式为:Ca(OH)2+2NH4Cl═CaCl2+2H2O+2NH3↑
(2)干燥氨气(3)黑色粉末变成红色(4)尾气没有处理
点评:根据铵盐和碱的反应规律,结合实验装置的特点及生成物的性质,通过分析判断来解答此类问题.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
(滨州市)工业上是用氨气还原氧化铜制取铜的。某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验。
查阅到的信息:
|
(2)氨气还原氧化铜制取铜的反应原理:2NH3+3CuO===3Cu+N2+3H2O
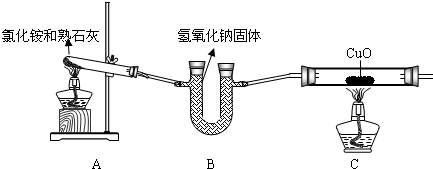
某小组设计了如下实验装置并进行实验:
氯化铵和熟石灰 氢氧化钠固体
 | |||||
 |
 |
试回答:
(1)写出装置A中试管内发生反应的化学方程式: ;
(2)装置B所起的作用是 ;
(3)装置C中可观察到的实验现象是 ;
(4)你认为该小组的实验设计还存在着哪些不足?



 3Cu+N2+3H2O
3Cu+N2+3H2O