题目内容
下列措施中,你认为不可行的是( )
A. 使用清洁能源代替煤和石油
B. 实施绿化工程,防治扬尘污染
C. 分类回收垃圾,并露天焚烧
D. 使用燃煤脱硫技术,防治SO2污染
如表列出的是生活和工业中常用的三种漂白剂.
种类 | 亚氯酸钠 | 二氧化氯 | 漂白粉 |
化学式 | NaClO2 | ClO2 | Ca(ClO)2和CaCl2 |
(1)三种漂白剂中,Ca(ClO)2属于___(填序号).
①混合物 ②化合物 ③氧化物
(2)ClO2中氯元素的化合价为___.
(3)表格中的物质(除CaCl2),氧元素的质量分数最大的是___.
(4)次氯酸钙[Ca(ClO)2]是漂白粉的有效成分.
①次氯酸钙在潮湿的空气中久置会生成具有漂白性的物质次氯酸(HClO)和难溶于水的白色固体,反应的化学方程式___,该反应的基本类型是___.
②工业使用漂白粉时常根据(4)中①的反应原理,通过添加少量的___(填序号)物质来解决漂白粉漂白缓慢的问题.
A 氢氧化钠 B 稀盐酸 C 氢氧化钙 D 氯化钠.
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),如图是动物饲料硫酸亚铁的生产工艺:
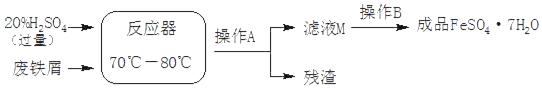
查阅资料:+2价的铁元素容易被空气中的氧气氧化。
回答下列问题:
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,还有__、__。
(2)操作A所用到的玻璃仪器有漏斗、玻璃棒和__。
(3)滤液M中肯定含有的溶质的化学式是__(只写一种)。
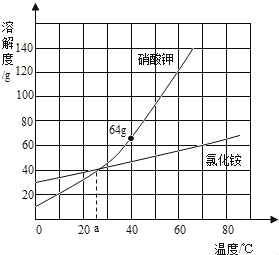
(4)已知硫酸亚铁的溶解度和析出晶体的组成如下表
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O |
根据上表,硫酸亚铁晶体(FeSO4•7H2O)冷却结晶温度最高不超过__℃.则操作B的步骤是:将滤液M在氮气环境中__、冷却结晶、过滤,即可得晶体,其中氮气的作用是__。
不少家庭养观赏鱼,有时会在鱼缸里放点鱼浮灵,可使水中的含氧量迅速增加,能有效提高鱼的成活率,并且有杀菌作用。某小组对鱼浮灵成份及原理进行了相关探究。
(实验1)检验气体
查阅资料1:鱼浮灵化学名称是过氧碳酸钠(xNa2CO3•yH2O2),常温下,过氧碳酸钠易溶于水并迅速放出氧气。
实验方案1:在一支试管中加入适量的鱼浮灵,_____(将后续操作及现象补充完整),证明产生的气体是氧气。
(实验2)检验反应后溶液中的溶质成分
猜想假设:猜想1:Na2CO3猜想2:Na2CO3和NaOH
查阅资料2:用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
NaOH溶液 | Na2CO3溶液 | |
滴加酚酞溶液 | 现象①_____ | 现象②_____ |
加入稀盐酸 | 无明显现象 | 现象③_____ |
加入澄清石灰水 | 无明显现象 | 现象④_____ |
加入 1%的CaCl2溶液 | 溶液变浑浊 | 溶液变浑浊 |
加入 0.1%的CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
表中的现象_____(填序号)为溶液变红色,现象③对应的化学反应方程式为_____。
实验方案 2:同学们取实验 1 反应后的溶液于试管中,加入过量_____(填“1%”或“0.1%”)的 CaCl 2 溶液,充分反应后过滤,取少量滤液,向滤液中滴加无色酚酞溶液,观察到滤液呈_____ 色,证明猜想 1 正确。
(反思拓展)根据上述探究可知,保存鱼浮灵时应注意_____。