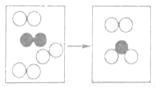
题目内容
下列各组物质全部是混合物的是( )
A. 空气、石油、冰水
B. 液化石油气、水煤气、甲烷
C. 赤铁矿石、石灰石、氧化铁
D. 酒精溶液、汽水、葡萄糖溶液
要善于从化学的视角认识世界。对下列事实解释错误的是( )
选项 | 事实 | 解释 |
A | 墙内开花墙外香 | 分子在不断运动 |
B | 50L水和50L酒精混合后的体积小于100L | 分子之间有间隔 |
C | 水蒸发变成水蒸气 | 分子大小发生改变 |
D | N2的化学性质不活泼,O2的化学性质比较活泼 | 不同分子性质不同 |
A. A选项 B. B选项 C. C选项 D. D选项
某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
(查阅资料)CuO+H2SO4=CuSO4+H2O
(进行实验)
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉(g) | 氧化铜(g) | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后上层清液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后上层清液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后上层清液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度(%) | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后上层清液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后上层清液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后上层清液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、______。
(2)实验中出现红色固体反应的化学方程式为_______;实验中出现气泡反应的化学方程式为_______。
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为_______。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因________。
(5) 根据实验2判断,下列说法不正确的是________(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应


 ”分别表示不同的原子。
”分别表示不同的原子。 B
B  C
C