题目内容
【题目】根据下表回答问题:
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,溶解度最大的物质是______________。
(2)40℃时,100g水中最多溶解NaCl______________g。
(3)甲是80℃含有110g水的KNO3溶液,经过如下操作,得到20gKNO3固体。
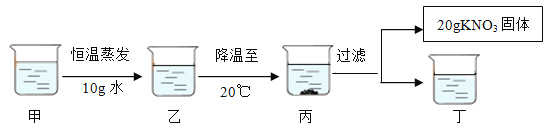
①丁溶液为_______________(选填“饱和”或“不饱和”)溶液。
②对以上过程的分析,正确的是_____________(填字母)。
A.甲到乙的过程中,溶质质量没有改变
B.乙中溶质与溶剂的质量比为169∶100
C.开始析出KNO3固体的温度在40℃至50℃之间
D.甲溶液的质量等于161.6g
【答案】 NH4Cl 36.6 饱和 AD
【解析】(1)由题中信息可知20℃时,溶解度最大的物质是氯化铵。(2)40℃时,100g水中最多溶解NaCl为36.6g;(3)①饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。丁溶液为析出晶体后的溶液,一定是饱和溶液。②A.甲到乙的过程中,没有固体析出,所以溶质质量没有改变;B.乙溶液中溶剂的质量为100g,可知乙溶液中溶质的质量为析出的溶质20g,与丙溶液中溶质的和,即20g+31.6g=51.6g,因而溶质与溶剂的质量比51.6:100;C.40℃时,硝酸钾的溶解度为63.9克,升温时溶解度增大,温度在40℃至50℃之间不会有硝酸钾晶体析出;D.由以上推断可知甲溶液的溶质为51.6g,溶剂为110g,溶液质量等于161.6g。选AD

练习册系列答案
相关题目
