题目内容
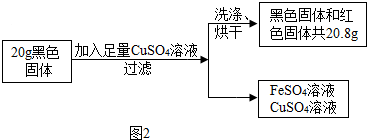
(五如14?青浦区二模)在AggO3和C5(gO3)五的混合液中,加入一定量的铁粉,充分反应后,有少量金属析出过滤后,向滤液中滴加稀盐酸,有白色沉淀析出,则理论上析出的少量金属是( )
| A.Cu | B.Ag | C.Fe和Cu | D.Cu和Ag |
在AglO3和Cu(lO3)2的混合液中,加入一定量的铁粉,铁首先会与硝酸银发生反应生成硝酸亚铁和银,然后与硝酸铜反应生成硝酸亚铁和铜,即:Fe+2AglO3=Fe(lO3)2+2Ag,Fe+Cu(lO3)2=Fe(lO3)2+Cu,向滤液中滴加稀盐酸,有白色沉淀析出,说明滤液中含有硝酸银,即加入的铁只与部分硝酸银反应,析出的固体是银,没有铜析出,也没有铁剩余,观察选项,故选B.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目