题目内容
【题目】已知某微粒(原子或离子)的核外共有2个电子层,其结构示意图为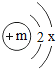 。
。
(1)若该微粒为原子时,则m=________。
(2)若该微粒为阴离子时,则m-2________(填“>”“<”或“=”)x。
(3)若x=8,请写出符合该组成结构且显不同电性的微粒的化学符号:__________________(各写一种)。
【答案】2+x<Na+(或Mg2+等)、O2-(或F-等)、Ne
【解析】
(1)在原子中,核内质子数等于核外电子数。根据原子的这一特点,可以确定m的值;(2)根据阴离子中核内质子数与核外电子数的关系比较;(3)根据稳定结构的成因进行讨论。
(1)在原子中,核内质子数等于核外电子数,故m=2+x;
(2)在阴离子中,核内质子数小于核外电子数,故m<2+x,即m-2<x;
(3)当最外层电子数是8时,该微粒处于稳定结构。当显正电性时,可以是钠原子失一个电子得到的,即Na+;也可以是镁原子失两个电子得到的,即Mg2+等。当显负电时,可以是氟原子得一个电子得到的,即F-;也可以是氧原子得两个电子得到的,即O2-;如果该微粒显电中性,即为氖原子(Ne)。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目