��Ŀ����
����Ŀ����ѧ������������ʶ���������������Ҫ�������ֶ�֮һ��
�����������벻�������������к������������� ������������� ����������ЧӦ�������� �������������Ҫ������ ��
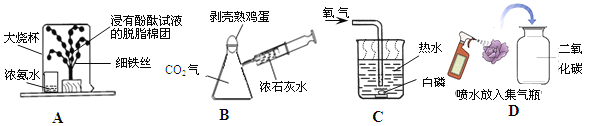
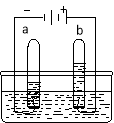
����ͼ��ʾ��װ�ÿ�����������ʶˮ����ɡ�a�Թ��е������� ��������Ӧ�Ļ�ѧ����ʽ�� ������b�Թ�������ķ����� ��
�ۻ�ѧ��ҽѧ������أ�Ϊ���ཡ�������ס��й���ѧ������������в�ҩ�з���������أ�C15H22O5��Ӧ����ű�����ƣ�������������˵������������2015��ŵ��������ѧ��ҽѧ����C15H22O5�� ��Ԫ����ɣ�̼����Ԫ�ص�ԭ�Ӹ������� ��0.4 mol C15H22O5��Լ���� ����ԭ�ӣ��ÿ�ѧ��������ʾ����
���𰸡���������N2�� 78% ������̼��CO2�� ��������SO2��
��������H2�� 2H2O ͨ�� 2H2��+ O2 �� �ô����ǵ�ľ�����飬��ȼ��Ϊ����
��3 15:22 1.204��1024
��������
��������������к�������������������N2�������������78%����������ЧӦ��������������̼��CO2��
�����������Ҫ��������������SO2��
���ˮ��ʵ�飬���Դ�������������������������Դ������������������������a�Թ��е�������������H2����ˮ�����Ӧ�Ļ�ѧ����ʽ����2H2O ͨ�� 2H2��+ O2 ��
b�Թ�������������Ϊ��������������������ȼ�ԣ�������b�Թ�������ķ��������ô����ǵ�ľ�����飬��ȼ��Ϊ������C15H22O5��3��Ԫ���������ѧʽ��Ԫ�ط������½ǵ����ֱ�ʾһ��������������ԭ�Ӹ�������̼����Ԫ�ص�ԭ�Ӹ�������15:22������һ��C15H22O5�����к���5����ԭ�ӣ���0.4 mol C15H22O5��Լ��������ԭ����=0.4 mol ��5��6.02��1023=1.204��1024

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�