题目内容
(2008?随州)有一包白色粉末,它可能是碳酸钙、氢氧化钠或两者的混合物.实验中学九(6)班某化学研究小组设计了三种方案进行实验鉴定:
方案I:取少量样品加入试管中,滴加稀盐酸,无气泡产生,张明认为白色粉末是氢氧化钠
方案Ⅱ:取少量样品加入试管中,滴加稀盐酸,有气泡产生,王宁认为白色粉末是碳酸钙
方案Ⅲ:取少量样品加入试管中,加足量的水振荡、静置,小组同学一致认为若完全溶解,则白色粉末是氢氧化钠;若试管底部出现沉淀,则白色粉末是碳酸钙.
(1)以上三种方案中,你认为合理的是
(2)请你帮助设计一个合理的方案,证明该粉末是两种物质的混合物.
方案I:取少量样品加入试管中,滴加稀盐酸,无气泡产生,张明认为白色粉末是氢氧化钠
方案Ⅱ:取少量样品加入试管中,滴加稀盐酸,有气泡产生,王宁认为白色粉末是碳酸钙
方案Ⅲ:取少量样品加入试管中,加足量的水振荡、静置,小组同学一致认为若完全溶解,则白色粉末是氢氧化钠;若试管底部出现沉淀,则白色粉末是碳酸钙.
(1)以上三种方案中,你认为合理的是
方案Ⅰ
方案Ⅰ
,理由是若有CaCO3,加盐酸必有气泡产生
若有CaCO3,加盐酸必有气泡产生
.(2)请你帮助设计一个合理的方案,证明该粉末是两种物质的混合物.
分析:(1)碳酸钙可以和稀盐酸反应生成了气体,而氢氧化钠不能和稀盐酸反应生成气体,据此可以判断白色粉末中没有碳酸钙而只有氢氧化钠,可据此解答;
(2)碳酸钙不溶于水,而氢氧化钠溶于水且呈碱性,可以据此设计方案来进行区分.
(2)碳酸钙不溶于水,而氢氧化钠溶于水且呈碱性,可以据此设计方案来进行区分.
解答:解:(1)碳酸钙可以和稀盐酸反应生成了气体,而氢氧化钠不能和稀盐酸反应生成气体,据此可以判断白色粉末中没有碳酸钙而只有氢氧化钠,故方案Ⅰ正确,而方案Ⅱ中没有排除氢氧化钠的存在,方案Ⅲ中同样没排除氢氧化钠的存在;
(2)碳酸钙不溶于水,而氢氧化钠溶于水且呈碱性,所以可以将白色粉末放入足量的水中,充分溶解后若有剩余的固体则说明在该混合物中含有碳酸钙,然后去上层清液,向其中滴加酚酞溶液,若溶液变红则说明该混合物中含有为氢氧化钠.
故答案为:(1)方案Ⅰ;若有CaCO3,加盐酸必有气泡产生;
(2)取适量样品加入试管中,加足量水振荡,静置;向清液中加入酚酞试液,试管底部有沉淀,清液变红色,则说明该混合物为氢氧化钠和碳酸钙的混合物.
(2)碳酸钙不溶于水,而氢氧化钠溶于水且呈碱性,所以可以将白色粉末放入足量的水中,充分溶解后若有剩余的固体则说明在该混合物中含有碳酸钙,然后去上层清液,向其中滴加酚酞溶液,若溶液变红则说明该混合物中含有为氢氧化钠.
故答案为:(1)方案Ⅰ;若有CaCO3,加盐酸必有气泡产生;
(2)取适量样品加入试管中,加足量水振荡,静置;向清液中加入酚酞试液,试管底部有沉淀,清液变红色,则说明该混合物为氢氧化钠和碳酸钙的混合物.
点评:本考点属于实验探究题,主要考查了氢氧化钙和碳酸钙的化学性质,通过对实验方案的设计和评价,能够培养学生的实验能力,养成对实验进行评价我自我设计实验的习惯.

练习册系列答案
相关题目
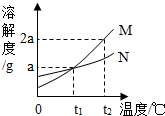 (2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )
(2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )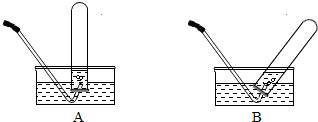 (2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究:
(2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究: