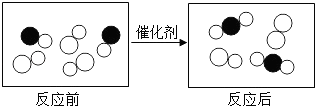
题目内容
【题目】研究金属镁与空气中氮气的反应,并检验生成的氮化镁(Mg3N2)的性质.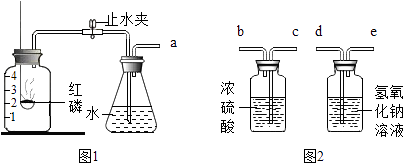
[资料在线]:
①金属镁与空气中的各主要成分 (括号中的物质) 都会反应分别会生成下列物质:
MgO(O2或CO2) Mg(OH)2(H2O) Mg3N2 (N2)
②Mg3N2的化学性质:Mg3N2+6H2O═3Mg(OH)2+2NH3↑
实验一,除去空气中的O2、CO2、H2O,得到的N2用于制取氮化镁.
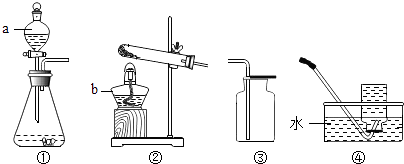
(1)足量的红磷燃烧后冷却(如图1),打开止水夹水倒流,水约占集气瓶空间容积的 .
(2)将(1)得到的气体依次通过→→→b两洗气瓶(如图2),将得到较纯的氮气.
(3)若(1)实验中改为燃烧足量的蜡烛,锥形瓶中的水改为氢氧化钠溶液.冷却后,打开止水夹后,要确保液体的倒流并达到(1)的现象,需进行的引发操作是(填一选项).
A.从a中鼓入少量空气
B.打开集气瓶瓶塞
C.打开锥形瓶瓶塞
实验二:若直接在空气中点燃镁粉,有淡黄色的固体物质 Mg3N2生成.
(4)写出生成氮化镁的化学方程式 , 该反应的基本类型是 .
(5)请你设计实验方案,验证生成的固体中有Mg3N2存在: .
【答案】
(1)![]()
(2)d,e,c
(3)A
(4)3Mg+N2 ![]() Mg3N2,化合反应
Mg3N2,化合反应
(5)将生成的固体溶于水,产生有刺激性气味的气体并能使湿润红色石蕊试纸变蓝
【解析】解:(1)足量的红磷燃烧消耗氧气,生成五氧化二磷,冷却后,打开止水夹水倒流,水约占集气瓶空间容积的 ![]() ;(2)氢氧化钠溶液可以除去空气中的CO2;浓硫酸具有吸水性,可以除去空气中的水蒸气;除杂时都是长进短出,导管口之间的连接顺序是:d→e→c;(3)蜡烛燃烧生成二氧化碳,氢氧化钠溶液可与二氧化碳反应,瓶内气压减小,冷却后,打开止水夹后,要确保液体的倒流并达到 (1)的现象,需进行的引发操作是从a中鼓入少量空气;(4)镁条与氮气反应的化学方程式为:3Mg+N2
;(2)氢氧化钠溶液可以除去空气中的CO2;浓硫酸具有吸水性,可以除去空气中的水蒸气;除杂时都是长进短出,导管口之间的连接顺序是:d→e→c;(3)蜡烛燃烧生成二氧化碳,氢氧化钠溶液可与二氧化碳反应,瓶内气压减小,冷却后,打开止水夹后,要确保液体的倒流并达到 (1)的现象,需进行的引发操作是从a中鼓入少量空气;(4)镁条与氮气反应的化学方程式为:3Mg+N2 ![]() Mg3N2;属于化合反应;(5)取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,证明产物中存在Mg3N2.答案:(1)
Mg3N2;属于化合反应;(5)取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,证明产物中存在Mg3N2.答案:(1) ![]() ;(2)d;e;c;(3)A;(4)3Mg+N2
;(2)d;e;c;(3)A;(4)3Mg+N2 ![]() Mg3N2;化合反应;(5)将生成的固体溶于水,产生有刺激性气味的气体并能使湿润红色石蕊试纸变蓝.
Mg3N2;化合反应;(5)将生成的固体溶于水,产生有刺激性气味的气体并能使湿润红色石蕊试纸变蓝.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请指出下列操作可能造成的不良后果.
(1)试管外壁有水时,不擦干直接加热_______;
(2)胶头滴管取用试剂后,将其倒置______;
(3)倾倒液体药品时,试剂瓶标签没有朝向手心______.
【题目】某化学活动小组为测定某铁合金的含铁量,做了如下实验,称取12.0g样品,放入质量为50g的烧杯中,再往烧杯中加入100.0g的稀盐酸,(杂质不与酸反应、不溶于水),并对烧杯进行了四次称量,记录的数据如下:
反应时间 | t0 | t1 | t2 | t3 |
烧杯总质量/g | 162.0 | 161.8 | 161.6 | 161.6 |
请进行有关计算:
⑴ 反应产生的氢气_________g;
⑵ 该铁合金中铁的质量分数为_______?(计算结果准确到0.1%)