题目内容
(2005?揭阳)如图是给病人输液用的氯化钠注射液的标签(部分文字)| 氯化钠注射溶液 【规格】500ml,4.5g 【适应症】各种原因所致的失水等. 【用法】静脉注射 0.9%,500ml |
(2)小明同学从某医院取来了氯化钠注射溶液65克;滴入足量的AgNO3溶液,充分反应后得到沉淀1.435克.通过计算,判断取来的注射液中氯化钠的含量是否达到要求.
【答案】分析:(1)由标签可知,500毫升这种注射溶液含有氯化钠的质量为4.5g,1000ml÷500ml×4.5g就是需氯化钠的质量;
(2)根据氯化钠与硝酸银反应的化学方程式和生成氯化银沉淀的质量,列出比例式,就可计算出参与反应的氯化钠的质量,然后根据溶质质量分数公式即可计算出氯化钠注射溶液中氯化钠的质量分数.然后对照标签数据,即可判断是否达到要求.
解答:解:(1)1000ml÷500ml×4.5g=9g;
(2)设参与反应的氯化钠的质量为x,
NaCl+AgNO3═AgCl↓+NaNO3
58.5--------143.5
x-----------1.435g
∴58.5:143.5=x:1.435g,
解之得:x=0.585g,
氯化钠注射溶液的质量分数为: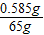 ×100%=0.9%.
×100%=0.9%.
对照标签可知,此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
答:(1)需氯化钠9g;
(2)此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.
(2)根据氯化钠与硝酸银反应的化学方程式和生成氯化银沉淀的质量,列出比例式,就可计算出参与反应的氯化钠的质量,然后根据溶质质量分数公式即可计算出氯化钠注射溶液中氯化钠的质量分数.然后对照标签数据,即可判断是否达到要求.
解答:解:(1)1000ml÷500ml×4.5g=9g;
(2)设参与反应的氯化钠的质量为x,
NaCl+AgNO3═AgCl↓+NaNO3
58.5--------143.5
x-----------1.435g
∴58.5:143.5=x:1.435g,
解之得:x=0.585g,
氯化钠注射溶液的质量分数为:
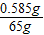 ×100%=0.9%.
×100%=0.9%.对照标签可知,此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
答:(1)需氯化钠9g;
(2)此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
相关题目
