题目内容
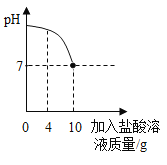
【题目】实验室有一瓶标签被腐蚀的盐酸,小文为了测定该盐酸中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示,请计算
(1)配制8g10%的NaOH溶液,需要NaOH的质量为多少?
(2)该盐酸中溶质的质量分数.
【答案】(1)0.8g (2)7.3%
【解析】
(1)配制8g10%的NaOH溶液,需要NaOH的质量为8g×10%=0.8g;
(2)由图可以看出,滴入10g盐酸恰好消耗掉8g10%的氢氧化钠溶液,也就是反应掉0.8g的氢氧化钠.
解:设10g盐酸中HCl的质量为x
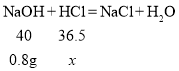
![]() x=0.73g
x=0.73g
该盐酸中溶质的质量分数为:![]()
答:(1)配制8g10%的NaOH溶液,需要NaOH的质量为 0.8g;
(2)该盐酸中溶质的质量分数为7.3%。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】研究金属的腐蚀对资源的利用和保护意义重大。
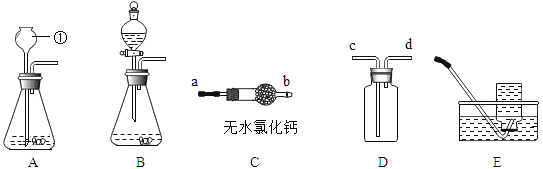
(1)为了探究铁锈蚀的条件,进行如图 1 所示实验。
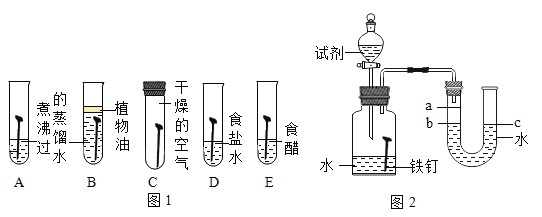
①通过观察实验 A、B、C 中的现象,经过科学严谨的推理得出结论:铁锈蚀是铁与____________发生化学反应的过程。
②实验 D 和 E 的目的是进一步探究铁在盐溶液和酸的环境中是否更容易锈蚀。铁跟醋酸(CH3COOH) 反 应生成醋酸亚铁[ (CH3COO)2Fe ]和氢气 ,请写出反应的化学方程式____________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
(提出问题)铁锈蚀速率与哪些因素有关。
(查阅资料)氯化钠溶液能导电;乙醇溶液不能导电。
(猜想假设)铁的锈蚀速率与下列因素有关:
I._________________;
II.氧气的含量;
Ⅲ.水溶液的导电性。
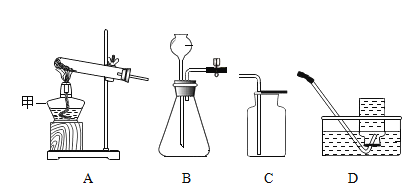
(实验探究)每次取两套如图 2 所示的装置,编号为甲、乙。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
影响 因素 | 实验设计 | 实验现象 | 实验结论及解释 |
I. | 装置甲放入 25℃恒温环境中, 装置乙放入 40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且 U型管中液面均由 b 处上升至 a处,所需时间甲>乙 | ____________ |
II. | 在相同温度下,向甲、乙两套装置的集气瓶中分别通入氧气和空气。 | 铁钉均锈蚀,且 U 型管中液面由 b 处上升至 a 处,所需时间甲___________乙 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
Ⅲ. | ______________________ | 两套装置中铁钉均锈蚀,且 U 型管中液面均由 b 处上升至 a 处,所需时间甲<乙 | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,铁的锈蚀速率加快。 |
(反思与提高)根据该探究实验以及你所学的知识,判断下列说法正确的是___________(填序号)。
A 金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B 金属腐蚀不一定要有氧气参加
C 金属越活泼,就越容易被锈蚀