题目内容
【题目】取可燃物12.4克充分燃烧,测得生成二氧化碳17.6克和水10.8克。试计算:
⑴ 该可燃物含有的元素各多少克_______________?
⑵ 若可燃物的相对分子质量为62,试通过计算写出化学式。_______________
【答案】可燃物中碳元素的质量为4.8g,氢元素的质量为1.2g,氧元素的质量为6.4g C2H6O2
【解析】
(1)17.6g CO2中C元素质量=![]() ;10.8gH2O中H元素质量=
;10.8gH2O中H元素质量=![]() ,可燃物质中C、H元素的质量和=4.8g+1.2g=6.0g<12.4g,所以可燃物中一定含有O元素,其质量=12.4g﹣6g=6.4g。可燃物中碳元素的质量为4.8g,氢元素的质量为1.2g,氧元素的质量为6.4g;
,可燃物质中C、H元素的质量和=4.8g+1.2g=6.0g<12.4g,所以可燃物中一定含有O元素,其质量=12.4g﹣6g=6.4g。可燃物中碳元素的质量为4.8g,氢元素的质量为1.2g,氧元素的质量为6.4g;
(2)可燃物中C、H、O的原子个数之比为![]() ;设:可燃物的化学式为CxH3xOx,根据题意知其相对分子质量为62,可得:12x+3x+16x=62,解之得:x=2。所以化学式为:C2H6O2。
;设:可燃物的化学式为CxH3xOx,根据题意知其相对分子质量为62,可得:12x+3x+16x=62,解之得:x=2。所以化学式为:C2H6O2。

【题目】化学是以实验为基础的科学,根据所学实验知识回答下列问题:

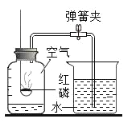
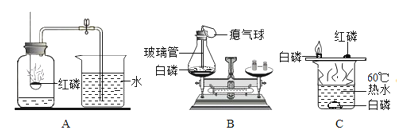
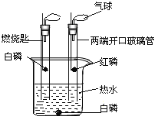
(1)研究可燃物燃烧的条件。已知:白磷的着火点是40℃。用如图所示装置进行实验:①向瓶内加入80℃左右的热水刚好没过燃烧匙中的白磷;②用注射器向瓶内推入空气,瓶内水面下降,当白磷露出水面时发生燃烧。
①白磷燃烧时发生反应的化学方程式为_________________________。
②此实验研究可燃物燃烧的条件是_________________________。
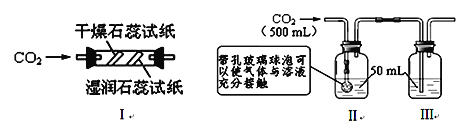
(2)利用表中装置进行二氧化碳性质的实验。实验前止水夹处于关闭状态。
实验装置 | 实验1 | 实验2 |
| Ⅰ. 将A试管充满CO2,B试管加入紫色石蕊溶液 Ⅱ. 密闭下,用针筒将A中部分CO2抽出 Ⅲ. 打开K | Ⅰ. 将A试管充满CO2,B试管加入稀盐酸 Ⅱ. 用针筒向A 中注入适量的饱和澄清石灰水,振荡 Ⅲ. 打开K |
①实验1中,可以验证CO2与水发生反应,看到的现象是______________________。
②实验2中,步骤Ⅱ中发生反应的化学方程式为____________________________;步骤Ⅲ中,打开K后发现A中液面____________________,有气泡产生。