题目内容
【题目】某硫酸厂产生的废水含有硫酸,需经处理至中性。兴趣小组的同学取100g酸性废水样品于烧杯中,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如下图所示。(假设废水中其他成分不与氢氧化钾反应)
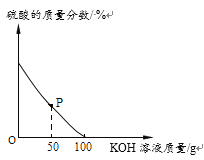
(1)P点对应溶液中含有的溶质有___________(填化学式)。
(2)计算废水中硫酸的质量分数__________。(精确到0.1%)
(3)请在如图中画出生成盐的曲线__________。

(4)工业上处理上述废水,应选用_____________更合理(填“KOH”或“CaO”)。(已知市场价格:KOH为9800元/t,CaO为70元/25kg。)
【答案】H2SO4、K2SO4 4.9% 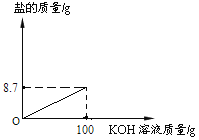 CaO
CaO
【解析】
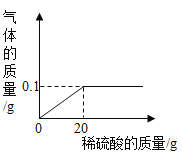
(1)取100g酸性废水样品于烧杯中,逐滴加入5.6%的氢氧化钾溶液,氢氧化钾与硫酸反应生成硫酸钾和水,由图可知,加入氢氧化钾溶液的质量为100g时,硫酸的质量分数为0,即硫酸的质量为0,也就是说,这时,硫酸和氢氧化钾恰好完全反应,故P点时,硫酸未完全反应,这时P点对应溶液中含有的溶质有:H2SO4、K2SO4;
(2)解:设废水中硫酸的质量分数为x,恰好完全反应时,生成盐的质量为y
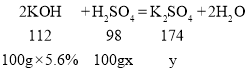
![]() ,x=4.9%
,x=4.9%
![]() ,y=8.7g
,y=8.7g
答:废水中硫酸的质量分数为4.9%;
(3)取100g酸性废水样品于烧杯中,逐滴加入5.6%的氢氧化钾溶液,氢氧化钾与硫酸反应生成硫酸钾和水,随着反应的进行,硫酸钾的质量逐渐增加,待硫酸完全反应后,质量不再变化,恰好完全反应时,生成硫酸钾的质量为8.7g,故画出生成盐的曲线为: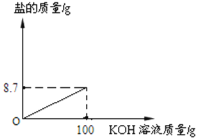
(4)氧化钙与硫酸反应生成硫酸钙和水,也可用于处理上述废水,且氧化钙的价格比较低廉,氢氧化钾价格昂贵,故选用CaO更合理。

【题目】利用碳酸钙、熟石灰等对燃煤烟气进行脱硫处理,可以减少SO2对空气的污染。
(1)SO2排放到空气中造成的环境问题是________(填序号)。
A引起温室效应 B形成酸雨 C增加PM2.5可吸入颗粒物 D形成雾霾
(2)熟石灰[Ca(OH)2]的乳浊液可用来吸收二氧化硫,某实验测得反应前后各物质的质量如下表所示:
物质 | 氢氧化钙 | 二氧化硫 | 氧气 | 硫酸钙 | 水 |
反应前的质量(g) | 14.8 | 12.8 | 3.2 | 0 | 5.4 |
反应后的质量(g) | 0 | 0 | 0 | 27.2 | x |
表中x的值为________,写出该实验发生反应的化学方程式_____________________。