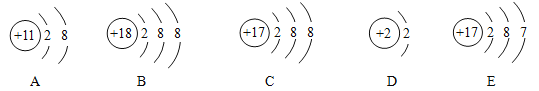
题目内容
【题目】学校课外兴趣小组的同学们为测定某铁合金样品(假定其中只含单质铁和单质碳)中铁的质量分数。他们各称取10g铁合金样品分别放到相同质量分数、不同质量的稀盐酸中,充分反应后,分别得到如下数据:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸质量/g | 25 | 50 | 75 | 100 |
生成氢气的质量/g | 0.1 | 0.2 | 0.3 | 0.3 |
(1)试计算该铁合金样品中铁的质量分数。______
(2)若要炼得这种铁合金100t,需要含Fe2O380%的赤铁矿多少吨?_____
【答案】84% 150t
【解析】
铁和稀盐酸反应生成氯化亚铁和氢气,依据表中的数据加入75g稀硫酸与100g稀硫酸生成的氢气质量都是0.3g,所以该样品最多能生成氢气的质量是0.3g。
(1)加入75g稀硫酸与100g稀硫酸生成的氢气质量都是0.3g,该样品最多能生成氢气的质量是0.3g
设生铁中铁的质量为x
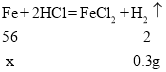
![]()
![]()
则该生铁样品中铁的质量分数为![]()
(2)设需要含Fe2O380%的赤铁矿质量是y![]()
![]()
答:该生铁样品中铁的质量分数为84%,若要炼得这种生铁100t,需要含Fe2O380%的赤铁矿150吨。

练习册系列答案
相关题目