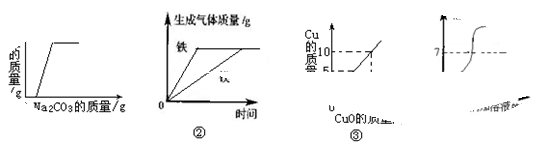
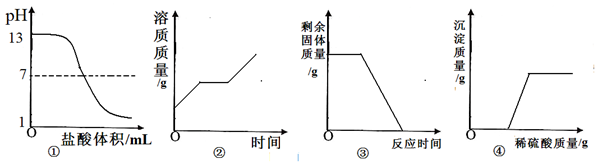
题目内容
有一包固体可能含有Ca(NO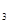 )
)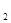 、Na
、Na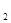 SO
SO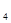 、Na
、Na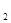 CO
CO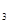 、FeCl
、FeCl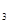 、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生 ③取②所得溶液少量,滴加BaCl
、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生 ③取②所得溶液少量,滴加BaCl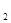 溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )
溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )
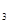 )
)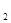 、Na
、Na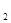 SO
SO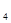 、Na
、Na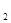 CO
CO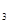 、FeCl
、FeCl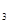 、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生 ③取②所得溶液少量,滴加BaCl
、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生 ③取②所得溶液少量,滴加BaCl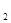 溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )
溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )A.肯定有Na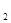 CO CO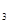 、Na 、Na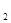 SO SO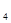 ,无FeCl ,无FeCl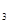 、Ca(NO 、Ca(NO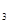 ) )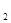 |
B.肯定有Na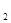 CO CO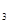 ,无FeCl ,无FeCl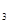 、Ca(NO 、Ca(NO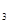 ) )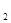 |
C.肯定有Na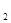 CO CO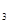 、Na 、Na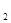 SO SO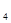 ,无FeCl ,无FeCl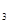 |
D.肯定有Na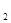 CO CO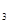 ,无FeCl ,无FeCl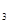 、KCl 、KCl |
B
根据步骤①:固体完全溶解成无色透明溶液.因为Ca2+可以与SO42-反应生成白色微溶物CaSO4,Ca2+也可以与CO32-反应生成白色沉淀CaCO3,所以Ca(NO3)2与Na2SO4、Na2CO3不能共存,又因为FeCl3显浅黄色,所以原固体中无FeCl3;
根据步骤②:取少量上述溶液,加过量稀硫酸,有气泡产生.因为稀硫酸可以与Na2CO3反应生成CO2气体,所以原固体中有Na2CO3,根据①的分析可知无Ca(NO3)2;
根据步骤③:取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.此处的白色沉淀是BaSO4,但步骤②中所加稀硫酸过量,所以原固体中无法确定有无Na2SO4.
综上所述,原固体中一定有Na2CO3,一定无Ca(NO3)2、FeCl3,不能确定的是Na2SO4、KCl.
故选B
根据步骤②:取少量上述溶液,加过量稀硫酸,有气泡产生.因为稀硫酸可以与Na2CO3反应生成CO2气体,所以原固体中有Na2CO3,根据①的分析可知无Ca(NO3)2;
根据步骤③:取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.此处的白色沉淀是BaSO4,但步骤②中所加稀硫酸过量,所以原固体中无法确定有无Na2SO4.
综上所述,原固体中一定有Na2CO3,一定无Ca(NO3)2、FeCl3,不能确定的是Na2SO4、KCl.
故选B

练习册系列答案
相关题目